题目内容
19. 氮、磷、砷为同主族元素,该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(RH3)性质是( )
氮、磷、砷为同主族元素,该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(RH3)性质是( )| A. | 稳定性 | B. | 沸点 | C. | R-H键长 | D. | 分子间作用力 |
分析 同一主族元素,元素的非金属性随着原子序数增大而减弱,
A.元素的非金属性越强,其氢化物越稳定;
B.氢化物的熔沸点与其相对分子质量成正比,但含有氢键的熔沸点最高;
C.原子半径越大,R-H键长越长;
D.分子的熔沸点越高,其分子间作用力越大.
解答 解:同一主族元素,元素的非金属性随着原子序数增大而减弱,
A.元素的非金属性越强,其氢化物越稳定,非金属性N>P>As,所以氢化物的稳定性随着原子序数增大而减弱,故A正确;
B.氢化物的熔沸点与其相对分子质量成正比,但含有氢键的熔沸点最高,所以沸点高低顺序是NH3、AsH3、PH3,故B错误;
C.原子半径越大,R-H键长越长,原子半径N<P<As,所以键长由短到长顺序NH3、PH3、AsH3,故C错误;
D.分子的熔沸点越高,其分子间作用力越大,沸点高低顺序是NH3、AsH3、PH3,则分子间作用力大小顺序是NH3、AsH3、PH3,故D错误;
故选A.
点评 本题考查同一主族元素氢化物性质递变规律,为高频考点,侧重考查熔沸点、分子间作用力、稳定性等知识点,注意氢化物的稳定性与化学键有关、熔沸点与分子间作用力有关,为易错题.

练习册系列答案
相关题目
9.石墨晶体是层状结构,右图是其晶体结构的俯视图,则图中7个六元环完全占有的碳原子数是( )
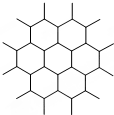

| A. | 10个 | B. | 14个 | C. | 18个 | D. | 24个 |
7.常温下,下列有关溶液的说法不正确的是( )
| A. | pH=3的二元弱酸H2R溶液与 pH=11的NaOH溶液混合后,混合液的pH等于7,则混合液中c(R2-)>c(Na+)>c(HR-) | |
| B. | 将0.2 mol/L的某一元弱酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液中存在:2c(OH-)+c(A-)=2c(H+)+c(HA) | |
| C. | 某物质的水溶液中由水电离出的c(H+)=1×10-amol/L,若a>7,则该溶液的pH为a或14-a | |
| D. | 相同温度下,0.2mol/L的醋酸溶液与0.1mol/L的醋酸溶液中c(H+)之比小于2:1 |
14.HBr气体的热分解温度比HI热分解温度高的原因是( )
| A. | HBr分子中的键长比HI分子中的键长短,键能大 | |
| B. | HBr分子中的键长比HI分子中的键长长,键能小 | |
| C. | HBr的相对分子质量比HI的相对分子质量小 | |
| D. | HBr分子间作用力比HI分子间作用力大 |
11.已知反应X+Y=M+N为吸热反应,对这个反应的下列说法中正确的是( )
| A. | X的能量一定低于M的能量 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 | |
| D. | X和Y的总能量一定低于M和N的总能量 |
8.常温下,下列说法错误的是( )
| A. | pH=6的NaHSO4溶液:c(Na+)+c(H+)=2c(SO42-)+c(OH-) | |
| B. | 0.1 mol/L NaHCO3溶液加水稀释后,c(H+)与c(OH-)的乘积不变 | |
| C. | pH相同的①CH3COONa、②NaClO二种溶液的c(Na+):①>② | |
| D. | 0.1 mol/L Na2SO3溶液:c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3) |
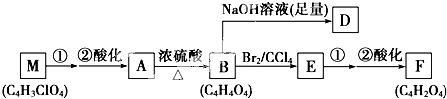
 +(2n-1)H2O.
+(2n-1)H2O. .
.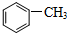 )中碳原子的杂化方式有SP2、SP3,甲苯能被酸性KMnO4溶液氧化成苯甲酸(
)中碳原子的杂化方式有SP2、SP3,甲苯能被酸性KMnO4溶液氧化成苯甲酸(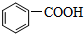 ),苯甲酸的沸点明显高于甲苯,其主要原因是苯甲酸分子间存在氢键.
),苯甲酸的沸点明显高于甲苯,其主要原因是苯甲酸分子间存在氢键.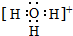 ,H3O+的键角大于(填“大于”、“小于”或“等于”)水分子的键角.
,H3O+的键角大于(填“大于”、“小于”或“等于”)水分子的键角.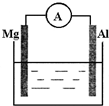 如图所示装置:(1)若烧杯中溶液为稀硫酸,则两极反应式为:负极Mg-2e-=Mg2+;正极2H++2e-=H2↑.该装置将化学能转化为电能.
如图所示装置:(1)若烧杯中溶液为稀硫酸,则两极反应式为:负极Mg-2e-=Mg2+;正极2H++2e-=H2↑.该装置将化学能转化为电能.