题目内容
16.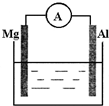 如图所示装置:(1)若烧杯中溶液为稀硫酸,则两极反应式为:负极Mg-2e-=Mg2+;正极2H++2e-=H2↑.该装置将化学能转化为电能.
如图所示装置:(1)若烧杯中溶液为稀硫酸,则两极反应式为:负极Mg-2e-=Mg2+;正极2H++2e-=H2↑.该装置将化学能转化为电能.(2)若烧杯中溶液为氢氧化钠溶液,则负极为Al,发生氧化反应,总反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
分析 (1)Mg比Al活泼,二者都可与酸反应,如电解池溶液为酸,则Mg为负极,发生氧化反应,Al为正极,发生还原反应;
(2)如电解质溶液为碱性,因Mg与碱不反应,而Al反应,则Al为负极,以此可解答该题.
解答 解:(1)该装置为原电池装置,将化学能转变为电能,镁比铝活泼,当溶液呈酸性时,镁作原电池负极,发生氧化反应,电极反应为Mg-2e-=Mg2+,铝作正极,发生还原反应,电极反应为2H++2e-=H2↑,
故答案为:Mg-2e-=Mg2+;2H++2e-=H2↑;化学;电;
(2)当溶液呈碱性时,铝能与NaOH溶液反应,而镁不反应,所以铝作负极发生氧化反应,镁作正极发生还原反应,电池总反应和铝与NaOH溶液的反应相同,为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:Al;氧化;2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
点评 本题考查原电池的组成和工作原理,题目难度不大,注意把握以镁、铝为电极材料,电解质溶液的酸碱性不同,电极反应不同,为易错点.

练习册系列答案
相关题目
19. 氮、磷、砷为同主族元素,该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(RH3)性质是( )
氮、磷、砷为同主族元素,该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(RH3)性质是( )
 氮、磷、砷为同主族元素,该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(RH3)性质是( )
氮、磷、砷为同主族元素,该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(RH3)性质是( )| A. | 稳定性 | B. | 沸点 | C. | R-H键长 | D. | 分子间作用力 |
7.下列各组微粒半径的排列顺序正确的是( )
| A. | Na<Si<P | B. | O2->Mg2+>Al3+ | C. | Ca>Ba>Ca2+ | D. | Cl->F>F- |
11.下列变化中可以说明SO2具有漂白性的是( )
| A. | 通入酸性高锰酸钾溶液中红色褪去 | |
| B. | 通入品红溶液中红色褪去 | |
| C. | 通入溴水中橙黄色褪去 | |
| D. | 通入氢氧化钠的酚酞溶液中红色褪去 |
1.下列变化中,属于物理变化的是( )
①加热氨水可得到氨气
②氯化铵晶体受热后由试管底部移到试管上部
③固体碘受热变成紫红色气体
④液氨汽化
⑤浓硝酸从无色液体变成黄色液体.
①加热氨水可得到氨气
②氯化铵晶体受热后由试管底部移到试管上部
③固体碘受热变成紫红色气体
④液氨汽化
⑤浓硝酸从无色液体变成黄色液体.
| A. | ①③④ | B. | ③④ | C. | ②③④ | D. | ③④⑤ |
5.氮化硼是一种新合成的结构材料,具有超硬、耐磨、耐高温的特点.下列各组物质熔化时,所克服的微粒间作用力与氮化硼熔化所克服的微粒间作用力相同的是( )
| A. | 氯化钠 | B. | 碳酸氢钠 | C. | 干冰 | D. | 二氧化硅 |

 .
.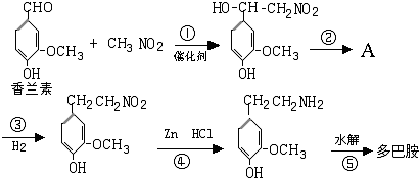
 .
.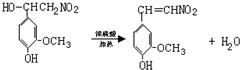 .
. .
.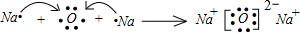 .
. ,该化合物中含有离子键、共价键键(填键的类型).
,该化合物中含有离子键、共价键键(填键的类型).