题目内容
13.25℃时,下列叙述正确的是( )| A. | NH4HSO4溶液中滴加NaOH溶液至pH=7,则c(Na+)=2c(SO42-) | |
| B. | 0.1 mol•L-1CH3COOH溶液与0.1 mol•L-1CH3COONa等体积混合pH<7,则c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | AgCl在水中溶解度与在稀盐酸中溶解度相同 | |
| D. | KNO3溶液和CH3COONH4溶液pH均为7,则两溶液中水的电离程度相同 |
分析 A.溶液为中性,则c(H+)=c(OH-),结合电荷守恒可知c(Na+)+c(NH4+)=2c(SO42-);
B.混合液的pH<7,说明醋酸的电离程度大于醋酸根离子的水解程度,溶液显示酸性,则c(H+)>c(OH-)、c(CH3COO-)>c(CH3COOH),结合物料守恒可得:c(CH3COO-)>c(Na+)>c(CH3COOH);
C.盐酸中含有氯离子,抑制了氯化银的水解;
D.醋酸铵溶液中,铵根离子、醋酸根离子都发生水解,促进了水的电离.
解答 解:A.NH4HSO4溶液中滴加NaOH溶液至pH=7,则c(H+)=c(OH-),由电荷守恒可知,溶液中应满足:c(Na+)+c(NH4+)=2c(SO42-),故A错误;
B.0.1 mol•L-1CH3COOH溶液与0.1 mol•L-1CH3COONa等体积混合pH<7,说明醋酸的电离程度大于醋酸根离子的水解程度,溶液显示酸性,则c(H+)>c(OH-)、c(CH3COO-)>c(CH3COOH),结合物料守恒c(CH3COO-)+c(CH3COOH)=2c(Na+)可得:c(CH3COO-)>c(Na+)>c(CH3COOH),所以溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-),故B正确;
C.AgCl的溶解度与溶液中银离子和氯离子浓度有关,在稀盐酸中氯离子抑制了氯化银的水解,所以氯化银在水中的溶解度大于在稀盐酸中的,故C错误;
D.KNO3溶液不存在水解,不影响水的电离,而CH3COONH4溶液中,铵根离子和醋酸根离子都发生水解,促进了水的电离,所以醋酸铵溶液中水的电离程度大于硝酸钾的,故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,注意明确物料守恒、电荷守恒、盐的水解原理的应用,明确影响难溶物溶解度、水的电离的因素,试题知识点较多,充分考查了学生的分析、理解能力.

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案| -C═C- | ─C≡C─ | ─CH3 | ─CH2CH3或─C2H5 |
| 双键 | 三键 | 甲基 | 乙基 |
| ─OH | -COO-R | ─CHO | ─COOH |
| 羟基 | 醛基 | 酯基 | 羧基 |

| A. |  有五种同分异构体 有五种同分异构体 | B. |  与BHT互为同系物 与BHT互为同系物 | ||
| C. | BHT具有还原性不能发生还原反应 | D. | 两种方法的反应类型都是加成反应 |
| A. | 22 | B. | 23 | C. | 24 | D. | 25 |
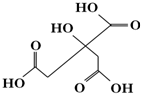
| A. | X分子式为C6H6O7 | |
| B. | 1 mol物质X可以和3 mol氢气发生加成 | |
| C. | X分子不可以发生消去反应 | |
| D. | 足量的X分别与等物质的量的NaHCO3、Na2CO3反应得到的气体物质的量相同 |
| A. | 边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀 | |
| B. | 当溶液出现红色且半分钟不褪色时即为确定终点 | |
| C. | 上述实验可用KCl标准溶液代替KSCN的标准溶液滴定Ag+ | |
| D. | 滴定时,必须控制溶液的pH,防止Fe3+水解,影响终点的观察. |
 如图所示的装置,试管中盛有水,气球a中盛有干燥的Na2O2粉末,U形管中注有浅红色的水.将气球用橡皮绳紧系在试管口.实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象是( )
如图所示的装置,试管中盛有水,气球a中盛有干燥的Na2O2粉末,U形管中注有浅红色的水.将气球用橡皮绳紧系在试管口.实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象是( )| A. | U形管内水的红水褪色 | B. | 试管内溶液变红 | ||
| C. | 气球a被吹大 | D. | U形管中水位不变 |
| A. | 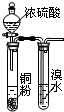 验证浓硫酸具有强氧化性 | B. |  制取干燥的NH3 | ||
| C. |  干燥、收集并吸收多余SO2 | D. | 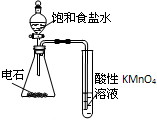 验证乙炔的还原性 |
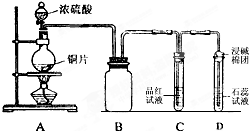 某同学为探究铜跟浓硫酸的反应情况,用如图所示装置进行了有关实验.
某同学为探究铜跟浓硫酸的反应情况,用如图所示装置进行了有关实验.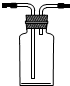 .
.