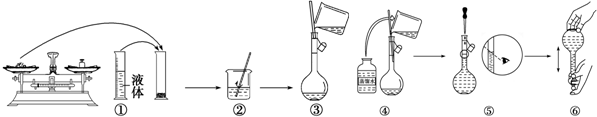
题目内容
13.A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素.又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体.请回答下列问题:
(1)元素F在周期表中的位置第三周期第ⅥA族.
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)S 2->O 2->Na+.
(3)由A、B、C三种元素以原子个数比4:2:3形成化合物X,X中所含化学键类型有离子键、黄家驹.检验该化合物中的阳离子的方法是NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3 ↑+H2O(用离子方程式表示).
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出D元素的最高价氧化物对应的水化物与E的最高价氧化物反应的离子方程式:Al2O3+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$2AlO2-+H2O.
分析 A、B、C、D、E、F六种短周期元素,其原子序数依次增大,C元素的原子最外层电子数是次外层电子数的三倍,原子只能有2个电子层,最外层电子数为6,则C是O元素;C与F同主族,则F是S元素;D与E和F同周期,即处于第三周期,D是所在周期原子半径最大的主族元素,则D是Na元素;E的原子序数大于钠小于硫,所以E的单质是固体;六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体,B的原子序数小于C,且B、C处于同一周期,所以B是N元素;A的单质是气体,则A的原子序数最小,所以A是H元素,据此解答.
解答 解:A、B、C、D、E、F六种短周期元素,其原子序数依次增大,C元素的原子最外层电子数是次外层电子数的三倍,原子只能有2个电子层,最外层电子数为6,则C是O元素;C与F同主族,则F是S元素;D与E和F同周期,即处于第三周期,D是所在周期原子半径最大的主族元素,则D是Na元素;E的原子序数大于钠小于硫,所以E的单质是固体;六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体,B的原子序数小于C,且B、C处于同一周期,所以B是N元素;A的单质是气体,则A的原子序数最小,所以A是H元素,
(1)F为S元素,在元素周期表中的位置是:第三周期第ⅥA族,
故答案为:第三周期第ⅥA族;
(2)电子层数越多离子半径越大,电子层结构相同,核电荷数越大离子半径越小,所以C、D、F三种元素形成的简单离子的半径由大到小的顺序是:S 2->O 2->Na+,
故答案为:S 2->O 2->Na+;
(3)由H、N、O三种元素以原子个数比4:2:3形成化合物X为NH4NO3,含有离子键、共价键,利用与强碱反应生成的氨气可以是红色石蕊试液变蓝色检验铵根离子,反应离子方程式为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3 ↑+H2O,
故答案为:离子键、共价键;NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3 ↑+H2O.
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,则为Al元素,最高价氧化物为Al2O3,D元素的最高价氧化物对应的水化物NaOH,二者反应的离子方程式:Al2O3+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$2AlO2-+H2O,
故答案为:Al2O3+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$2AlO2-+H2O.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,综合考查学生分析能力、逻辑推理能力及对知识的迁移运用,需要学生具备扎实的基础,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 溶液中pH值不变,有H2放出 | B. | 液液中Na+数目减少,有O2放出 | ||
| C. | 溶液中pH值增大,有O2放出 | D. | 溶液中Na+浓度增大,有O2放出 |
| A. | C4H10和C20H42 互为同系物 | B. | 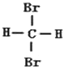 和 和 互为同分异构体 | ||
| C. | 12C和14C互为同素异形体 | D. | H2、D2和T2互为同位素 |
| 操作 | 现象 | 结论 |
| 将有色鲜花瓣放入干燥的Cl2中 | 过一会儿鲜花瓣褪色 | (1)湿润的氯气具有漂白性 |
| 将干燥的有色布条放入新制的氯水中 | 过一段时间该布条褪色 | |
| 将有色干花瓣放入干燥的Cl2中 | (2)不褪色 | (4)干燥的氯气不具有漂白性 |
| 将干燥的有色布条放入干燥的Cl2中 | (3)不褪色 |
①除去乙烷中少量的乙烯:通入酸性高锰酸钾溶液,气液分离;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
| A. | C-H之间是sp形成的σ键,C-C之间全是未参加杂化的2p轨道形成的π键 | |
| B. | C-C之间是sp形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键 | |
| C. | sp杂化轨道形成σ键、未杂化的两个2p轨道形成两个π键,且杂化轨道与未杂化轨道互相平行 | |
| D. | sp杂化轨道形成σ键、未杂化的两个2p轨道形成两个π键,且杂化轨道与未杂化轨道互相垂直 |
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| C. | 工业上冶炼Al,使用Al2O3而不使用AlCl3,是因为AlCl3是共价化合物,熔融不导电 | |
| D. | 铜具有良好的导电性,常用来制作印刷电路板 |