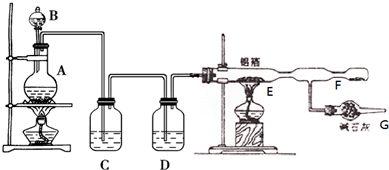
题目内容
3.2011年为国际化学年,主题为“化学-我们的生活,我们的未来”.下列说法不正确的是( )| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| C. | 工业上冶炼Al,使用Al2O3而不使用AlCl3,是因为AlCl3是共价化合物,熔融不导电 | |
| D. | 铜具有良好的导电性,常用来制作印刷电路板 |
分析 A.绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染;
B.根据煤油和钠的性质判断;
C.氯化铝是共价化合物;
D.铜具有良好的导电性.
解答 解:A.绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染,故A错误;
B.石油分馏可得到煤油,煤油是碳氢化合物能燃烧,煤油和钠不反应,且钠的密度大于煤油的密度,所以煤油能保存少量金属钠,故B正确;
C.AlCl3的熔融态不导电,是氯化铝是共价化合物,熔融不能产生离子,所以工业上冶炼Al,使用Al2O3而不使用AlCl3,故C正确;
D.铜具有良好的导电性,可用来制作印刷电路板,故D正确;
故选:A.
点评 本题考查了绿色化学的核心、金属的冶炼、石油的分馏及钠的性质、铜的性质,题目难度不大,把握绿色化学的核心是解题关键,题目难度不大.

练习册系列答案
相关题目
14.对物质进行科学分类是化学学习与研究的常用方法.人们在探索物质世界的过程中对酸、碱的概念不断改变和提升.从目前的化学理论看,下列有关说法正确的是( )
| A. | 人们最早先根据味道,来获得朴素的酸、碱概念:酸一定有酸味的,碱一定是有涩味的 | |
| B. | 波义耳基于指示剂变色来分辨酸碱,酸一定能使石蕊变红,碱一定能使石蕊变蓝 | |
| C. | 阿累尼乌斯创立了酸碱电离理论,酸碱电离理论不适用于非水溶液 | |
| D. | 酸碱质子理论:凡是能给出H+的物质就是酸,凡是能结合H+的物质就是碱,这是酸、碱的最终定义 |
11.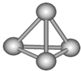 科学家在某星球的大气层中探测到N4分子,经研究发现其空间结构与白磷(P4)相似(如图),为正四面体构型,且分子中所有N原子均达到8电子的稳定结构.已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中不正确的是( )
科学家在某星球的大气层中探测到N4分子,经研究发现其空间结构与白磷(P4)相似(如图),为正四面体构型,且分子中所有N原子均达到8电子的稳定结构.已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中不正确的是( )
 科学家在某星球的大气层中探测到N4分子,经研究发现其空间结构与白磷(P4)相似(如图),为正四面体构型,且分子中所有N原子均达到8电子的稳定结构.已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中不正确的是( )
科学家在某星球的大气层中探测到N4分子,经研究发现其空间结构与白磷(P4)相似(如图),为正四面体构型,且分子中所有N原子均达到8电子的稳定结构.已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中不正确的是( )| A. | N4和N2互为同素异形体,两者之间的转化为非氧化还原反应 | |
| B. | 1mol N4分子的总能量比1mol N2分子的总能量高,说明相同条件下N4分子化学性质更稳定 | |
| C. | N4气体转化为N2的热化学方程式为:N4(g)═2N2(g),△H=-882 kJ•mol-1 | |
| D. | 白磷(P4)的熔、沸点比N4分子的高 |
18.下列实验设计能够成功的是( )
| A. | 检验亚硫酸钠试样是否变质:试样$\stackrel{溶解}{→}$溶液$\stackrel{硝酸钡溶液}{→}$白色沉淀$\stackrel{稀硝酸}{→}$沉淀不溶解 | |
| B. | 除去乙酸乙酯中混有的乙酸:混合液$\stackrel{饱和碳酸钠溶液振荡}{→}$溶液分层$\stackrel{分液}{→}$得上层液体 | |
| C. | 证明酸性条件下H2O2氧化性比I2强:NaI溶液$\stackrel{30%H_{2}O_{2}溶液稀硝酸及淀粉}{→}$溶液变蓝色 | |
| D. | 鉴定盐A的成分是FeBr2: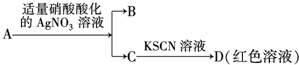 |
8.下列有关说法正确的是( )
| A. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| C. | N2(g)+3H2(g)═2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2 )和H2的平衡转化率均增大 | |
| D. | 500℃、30Mpa下,将0.5molN2和1.5molH2置于密闭容器中充分反应,放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ/mol |
1.A、B两种有机化合物,当混合物总质量一定时,无论A、B以何种比例混合,完全燃烧时产生的水的量均相等,肯定符合上述条件的A、B是( )
①同分异构体; ②具有相同的最简式; ③乳酸与聚乳酸; ④含氢的质量分数相同⑤苯乙烯和聚苯乙烯 ⑥葡萄糖与淀粉 ⑦甲苯与甘油.
①同分异构体; ②具有相同的最简式; ③乳酸与聚乳酸; ④含氢的质量分数相同⑤苯乙烯和聚苯乙烯 ⑥葡萄糖与淀粉 ⑦甲苯与甘油.
| A. | ①②③④ | B. | ①②④⑤ | C. | ①②③④⑤⑦ | D. | ①②④⑤⑦ |
2.芳香族化合物M的结构如图所示,下列叙述正确的是( )


| A. | M有3种不同的官能团 | |
| B. | M可发生取代、加成、消去和聚合等4种有机反应 | |
| C. | 1molM完全燃烧生成CO2和H2O,需要5molO2 | |
| D. | 1molM与足量的NaOH溶液反应,最多需要4molNaOH |