题目内容
4.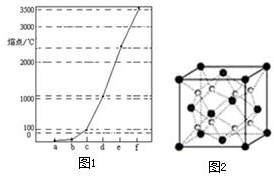 图1中a~f分别表示有H、C、N、Na、Si、Cu元素组成的单质,其中c、d均是热和电的良导体,单质分别对应的熔点如图所示:
图1中a~f分别表示有H、C、N、Na、Si、Cu元素组成的单质,其中c、d均是热和电的良导体,单质分别对应的熔点如图所示:(1)从电负性角度分析,C、Si和N元素的非金属活泼性由强至弱的顺序为N>C>Si;
(2)图1中d单质对应元素原子的电子排布式1s22s22p63s23p63d104s1,用价层电子对互斥理论推断,单质a、b、f对应的元素以原子个数比1:1:1形成的分子中化学键的键角为180°.
(3)a与b元素形成的10电子中性分子X,X溶于水后的溶液滴入到含d元素高价离子的溶液中至过量,生成含d元素离子的化学式为[Cu(NH3)4]2+.
(4)过渡金属元素铁能形成多种配合物,如[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.
①尿素(H2NCONH2)分子中C原子的杂化方式是sp2杂化.
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=5.其分子结构如图2所示,Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于分子晶体(填晶体类型).
分析 H、C、N、Na、Cu、Si元素组成的单质中,Na、Cu为金属晶体,均是热和电的良导体,钠的熔点较低,C、Si的单质为原子晶体,且C单质的熔沸点大于Si原子晶体的熔沸点,H、N对应的单质为分子晶体,其中氢气的熔点最低,由图熔点的高低顺序可知a为H,b为N,c为Na,d为Cu,e为Si,f为C.
(1)电负性越大,非金属性越强;
(2)d为Cu,Cu元素为29号元素,原子核外有29个电子,根据核外电子排布规律书写;
单质a、b、f对应的元素以原子个数比1:1:1形成的分子为HCN,碳原子价层电子对数为2,没有孤电子对,为直线型结构;
(3)a与b的元素形成的10电子中性分子X为NH3,与铜离子配位形成四氨合铜络离子;
(4)①尿素(H2NCONH2)分子中C原子与O原子之间形成C=O双键,与N原子之间形成C-N单键,没有孤对电子,其杂化轨道数目为3;
②Fe原子最外层电子数为8,CO为配体,CO分子提供1对电子,进而计算x的值;
Fe(CO)x常温下呈液态,熔沸点低,易溶于非极性溶剂,可判断Fe(CO)x晶体属于分子晶体.
解答 解:H、C、N、Na、Cu、Si元素组成的单质中,Na、Cu为金属晶体,均是热和电的良导体,钠的熔点较低,C、Si的单质为原子晶体,且C单质的熔沸点大于Si原子晶体的熔沸点,H、N对应的单质为分子晶体,其中氢气的熔点最低,由图熔点的高低顺序可知a为H,b为N,c为Na,d为Cu,e为Si,f为C.
(1)电负性越大,非金属性越强,故非金属性N>C>Si,故答案为:N>C>Si;
(2)d为Cu,Cu元素为29号元素,原子核外有29个电子,核外电子排布为:1s22s22p63s23p63d104s1;
单质a、b、f对应的元素以原子个数比1:1:1形成的分子为HCN,碳原子价层电子对数为2,没有孤电子对,为直线型结构,分子中化学键的键角为180°,
故答案为:1s22s22p63s23p63d104s1;180°;
(3)a与b的元素形成的10电子中性分子X为NH3,Cu2+提供空轨道,氨气分子提供孤对对子,通过配位键形成[Cu(NH3)4]2+,
故答案为:[Cu(NH3)4]2+;
(4)①尿素(H2NCONH2)分子中C原子与O原子之间形成C=O双键,与N原子之间形成C-N单键,没有孤对电子,其杂化轨道数目为3,杂化方式为sp2杂化,故答案为:sp2杂化;
②Fe原子最外层电子数为8,CO为配体,CO分子提供1对电子,则8+2x=18,故x=5;
Fe(CO)x常温下呈液态,熔沸点低,易溶于非极性溶剂,可判断Fe(CO)x晶体属于分子晶体,
故答案为:5;分子晶体.
点评 本题是对物质结构的考查,涉及元素周期律、核外电子排布、价层电子对互斥理论、杂化方式、配合物、晶体类型与性质等,难度中等,旨在考查对知识的综合运用和掌握.

| A. | A2BC3 | B. | A4BC4 | C. | ABC4 | D. | A4B2C2 |
| A. | C2=2C1 | B. | C2>2C1 | C. | C2<2C1 | D. | C1=2C2 |
| A. | H2O2既是氧化剂又是还原剂 | B. | H2O2是氧化剂 | ||
| C. | O2既是氧化产物又是还原产物 | D. | 该反应转移4mole- |
| A. | 0.01 mol/L的H2A溶液 | |
| B. | 0.01 mol/L的NaHA溶液 | |
| C. | 0.02 mo|/L的NaOH溶液与0.02 mol/L的NaHA溶液等体积混合 | |
| D. | 0.02 mol/L的HCl溶液与0.04 mol/L的NaHA溶液等体积混合 |
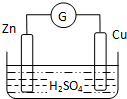
| A. | 外电路中电流由铜极流向锌极 | B. | 正极为电子流入的一极 | ||
| C. | 金属铜为负极 | D. | 发生还原反应的为正极 |
| A. | 无色溶液中:K+、Na+、MnO4-、SO42- | |
| B. | 在酸性溶液中:Ba2+、Na+、SO42-、Cl- | |
| C. | 加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+ | |
| D. | 含大量Fe2+溶液中:K+、Cl-、NO3-、Na+ |