题目内容
14.室温时,将盛有NH4HCO3烧杯放入盛有少量醋酸的大烧杯中.然后向小烧杯中加入盐酸溶液,反应剧烈,大烧杯中的醋酸逐渐凝固(乙酸的熔点:16.6℃),下列说法正确的是( )| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为化学能 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O△H>0 |
分析 A、反应后醋酸凝固,说明反应是吸热反应;
B、吸热反应把热能转化为化学能;
C、依据反应前后能量守恒分析判断;
D、热化学方程式需要标注物质聚集状态.
解答 解:A、大烧杯中的醋酸逐渐凝固说明反应吸收热量导致温度降低,即NH4HCO3与HCl的反应为吸热反应,故A错误;
B、因反应为吸热反应,即热能转化为化学能,故B正确;
C、因反应为吸热反应,则反应物的总能量<生成物的总能量,故C错误;
D、书写热化学方程式时,应注明物质的状态,故D错误;
故选B.
点评 本题考查化学反应能量变化判断,热化学方程式书写方法,能量守恒的应用分析是解题关键,题目难度中等.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
2.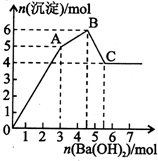 向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水).以下推断正确的是( )
向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水).以下推断正确的是( )
 向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水).以下推断正确的是( )
向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水).以下推断正确的是( )| 氢氧化物 | 溶液pH | |||
| 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
| Fe(OH)3 | 2.3 | 3.4 | ||
| Al(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |
| A. | 据图计算原溶液中c(Cl-)=c(SO42-) | |
| B. | OA段产生的沉淀为BaSO4和Fe(OH)3 | |
| C. | AB段可能发生的反应是:2SO42-+2Ba2++Al3++30H-=2BaSO4k+Al(OH)3↓ | |
| D. | C点溶液呈碱性的原因是AlO2-水解,其离子方程式为:AlO2-+2H2O=Al(OH)3+OH- |
5.下列有机物的系统名称中,正确的是( )
| A. | 2,4,4-三甲基戊烷 | B. | 4-甲基-2-戊烯 | ||
| C. | 4-甲基-5-乙基庚烷 | D. | 1,2,4-三甲基丁烷 |
19.2014年5月3日,科学家在粒子加速器中,用钙离子轰击放射性元素锫,成功生成117号元素,有关该元素的说法正确的是( )
| A. | 117号元素位于第七周期第ⅦB族 | B. | 117号元素是一种金属元素 | ||
| C. | 117号元素最外层有5个电子 | D. | 117号元素没有正化合价 |
6.下列物质中既含有共价键又含离子键的化合物是( )
| A. | NaCl | B. | Al2O3 | C. | NaOH | D. | CH4 |
3.2H、13C、15N、18O、34S等常用作环境分析指示物.下列有关说法正确的是( )
| A. | 34S原子核内中子数为16 | |
| B. | 1H${\;}_{2}^{16}$O和1H${\;}_{2}^{18}$O的相对分子质量不同 | |
| C. | 13C和15N原子的原子序数相差2 | |
| D. | 2H+结合OH-的能力比1H+的更强 |
4.现有部分短周期元素的原子结构如下表:
(1)写出X的元素符号:N,Z元素原子的质量数为23.
(2)元素Y的最高价氧化物的结构式为O=C=O,Z元素的单质在空气中燃烧产物的电子式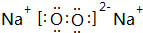 ,用电子式表示X的气态氢化物的形成过程
,用电子式表示X的气态氢化物的形成过程 .
.
(3)Y的最高价氧化物和Z元素的单质在空气中燃烧产物发生反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2;若反应过程中,转移电子数为6.02×1023,则消耗Y的最高价氧化物的质量为1mol.
| 元素 编号 | 元素原子结构 |
| X | 原子结构示意图为 |
| Y | 最外层电子数是次外层电子数的2倍 |
| Z | 原子核内含有12个中子,且其离子的结构示意图为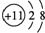 |
(2)元素Y的最高价氧化物的结构式为O=C=O,Z元素的单质在空气中燃烧产物的电子式
 ,用电子式表示X的气态氢化物的形成过程
,用电子式表示X的气态氢化物的形成过程 .
.(3)Y的最高价氧化物和Z元素的单质在空气中燃烧产物发生反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2;若反应过程中,转移电子数为6.02×1023,则消耗Y的最高价氧化物的质量为1mol.
 将一定质量的Mg-Al合金投入到100mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加5mol/LNaOH溶液至过量,生成沉淀质量与加入NaOH溶液的体积关系如下图所示.
将一定质量的Mg-Al合金投入到100mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加5mol/LNaOH溶液至过量,生成沉淀质量与加入NaOH溶液的体积关系如下图所示.