题目内容
11.短周期元素A、B、C、D、E的原子序数依次增大,已知:①C的最高价氧化物对应的水化物与其气态氢化物反应可生成盐M;
②A的氧化物是生活中最常见液体,A、E同主族,C与B、D相邻;
③A、B、C、D四种元素组成一种离子化合物F,其组成原子数之比为5:1:1:3.
请回答下列问题:
(1)M的化学式为:NH4NO3,A在周期表中的位置:第一周期IA族.
(2)化合物E2D2中阴、阳离子个数比为:1:2,与H2O反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑.
(3)F含有的化学键类型为:离子键、共价键,化合物EDA的电子式为
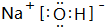 ,F溶液与足量EDA的稀溶液混合,其离子方程式为:NH4++HCO3-+OH-=NH3.H2O+2CO32-+H2O.
,F溶液与足量EDA的稀溶液混合,其离子方程式为:NH4++HCO3-+OH-=NH3.H2O+2CO32-+H2O.(4)氯气与C的气态氢化物相遇有白烟及C2生成,写出其化学反应方程式:3Cl2+8NH3=N2+6NH4Cl.
分析 短周期元素A、B、C、D、E的原子序数依次增大,①C的最高价氧化物对应的水化物与其气态氢化物反应可生成盐M,则C为N元素,M为NH4NO3;②A的氧化物是生活中最常见液体,该液体应是水,结合原子序数可知,则A为H元素;A、E同主族,E的原子序数大于氮,则E为Na元素;C与B、D相邻,B、D原子序数均小于Na,可推知B为碳元素、D为O元素;③A、B、C、D四种元素组成一种离子化合物F,其组成原子数之比为5:1:1:3,则F为NH4HCO3,据此解答.
解答 解:短周期元素A、B、C、D、E的原子序数依次增大,①C的最高价氧化物对应的水化物与其气态氢化物反应可生成盐M,则C为N元素,M为NH4NO3;②A的氧化物是生活中最常见液体,该液体应是水,结合原子序数可知,则A为H元素;A、E同主族,E的原子序数大于氮,则E为Na元素;C与B、D相邻,B、D原子序数均小于Na,可推知B为碳元素、D为O元素;③A、B、C、D四种元素组成一种离子化合物F,其组成原子数之比为5:1:1:3,则F为NH4HCO3.
(1)由上述分析可知,M的化学式为:NH4NO3,A为H元素,在周期表中的位置:第一周期IA族,
故答案为:NH4NO3;第一周期IA族;
(2)化合物Na2O2由钠离子与过氧根离子构成,阴、阳离子个数比为1:2,与H2O反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,
故答案为:1:2;2Na2O2+2H2O=4NaOH+O2↑;
(3)F为NH4HCO3,含有的化学键类型为:离子键、共价键,化合物EDA为NaOH,其电子式为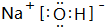 ,F溶液与足量EDA的稀溶液混合,其离子方程式为:NH4++HCO3-+OH-=NH3.H2O+2CO32-+H2O,
,F溶液与足量EDA的稀溶液混合,其离子方程式为:NH4++HCO3-+OH-=NH3.H2O+2CO32-+H2O,
故答案为:离子键、共价键;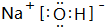 ;NH4++HCO3-+OH-=NH3.H2O+2CO32-+H2O;
;NH4++HCO3-+OH-=NH3.H2O+2CO32-+H2O;
(4)氯气与C的气态氢化物NH3相遇有白烟及N2生成,有氯化铵生成,化学反应方程式:3Cl2+8NH3=N2+6NH4Cl,故答案为:3Cl2+8NH3=N2+6NH4Cl.
点评 本题考查结构性质位置关系综合应用,推断元素是解题关键,(3)中离子方程式书写为易错点,注意氢氧根离子足量,铵根离子与碳酸氢根均反应,且为稀溶液,得到一水合氨.

| A. | 117号元素位于第七周期第ⅦB族 | B. | 117号元素是一种金属元素 | ||
| C. | 117号元素最外层有5个电子 | D. | 117号元素没有正化合价 |
| A. | NaCl | B. | Al2O3 | C. | NaOH | D. | CH4 |
| A. | CH3CH2OH→CH2=CH2↑+H2O | |
| B. | CH3CHBrCH3+NaOH→CH3CH=CH2↑+NaBr+H2O | |
| C. |  CHClCH2Cl+2NaOH→ CHClCH2Cl+2NaOH→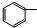 C≡CH+2NaCl+2H2O C≡CH+2NaCl+2H2O | |
| D. | 2CH3OH→CH3-O-CH3+H2O |
| A. | 34S原子核内中子数为16 | |
| B. | 1H${\;}_{2}^{16}$O和1H${\;}_{2}^{18}$O的相对分子质量不同 | |
| C. | 13C和15N原子的原子序数相差2 | |
| D. | 2H+结合OH-的能力比1H+的更强 |
| A. | 若XY3分子中X原子处于正三角形的中心,则XY3分子为非极性分子 | |
| B. | C2H5OH与C2H5Br相比,前者的沸点远高于后者,其原因是前者的分子间存在氢键 | |
| C. | 同周期ⅠA族元素和ⅦA族元素之间只能形成离子化合物 | |
| D. | 由两种非金属元素组成的化合物分子中只可能有极性键,不会有非极性键 |
| A. | 碱金属都可以保存在煤油中 | |
| B. | 碱金属元素的单质硬度小、密度小、熔点低 | |
| C. | 在空气中加热均可生成多种氧化物 | |
| D. | 碱金属与水反应,均漂浮在水面上 |
 将一定质量的Mg-Al合金投入到100mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加5mol/LNaOH溶液至过量,生成沉淀质量与加入NaOH溶液的体积关系如下图所示.
将一定质量的Mg-Al合金投入到100mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加5mol/LNaOH溶液至过量,生成沉淀质量与加入NaOH溶液的体积关系如下图所示.