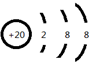题目内容
8.下列实验能达到目的是( )| A. |  构成锌-铜原电池 | B. | 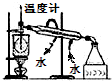 碘的CCl4溶液中分离I2并回收CCl4 | ||
| C. | 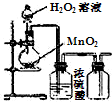 制取O2 | D. | 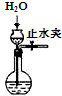 检查装置气密性 |
分析 A.Zn直接与硫酸铜溶液反应,不能形成原电池反应;
B.温度计位置错误;
C.氧气的密度比空气大,应用向上排空法收集;
D.可先关闭止水夹,形成液面差,判断水柱是否变化.
解答 解:A.Zn直接与硫酸铜溶液反应,应将电极互换,否则不能形成原电池反应,故A错误;
B.温度计用于测量馏分的温度,应位于蒸馏烧瓶的支管口附近,故B错误;
C.氧气的密度比空气大,应用向上排空法收集,故C错误;
D.可先关闭止水夹,至长颈漏斗液面高于圆底烧瓶液面形成液面差,如一段时间内水柱不发生改变,则气密性良好,故D正确.
故选D.
点评 本题考查较为综合,涉及原电池、物质的分离、气体的制备以及气密性的检查等知识,为高考常见题型,侧重于学生的分析、实验能力的考查,难度不大,注意把握实验的严密性以及可行性的评价.

练习册系列答案
相关题目
1.几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X、Y元素的金属性X<Y | |
| B. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,Z单质与W的常见单质直接生成ZW2 |
19.下列化学式中,具有非极性键的离子化合物是( )
| A. | H2O2 | B. | MgF2 | C. | NaOH | D. | Na2O2 |
16.下列结论正确的是( )
①粒子半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
①粒子半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
| A. | ②⑤⑦ | B. | ②④⑥ | C. | ②④⑤⑥⑦ | D. | ②⑥⑦ |
13.下列各组物质中,化学键的类型相同的是( )
| A. | CaCl2和Na2S | B. | Na2O和Na2O2 | C. | N2和Ne | D. | HCl和NaOH |
17.下列化合物中阳离子和阴离子电子层结构相同的是( )
| A. | NaCl | B. | MgF2 | C. | CaF2 | D. | K2O |
 ,⑥与⑨形成的5原子分子的结构式为
,⑥与⑨形成的5原子分子的结构式为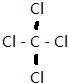 .
.