题目内容
4.使用单质铜制取硝酸铜,最适宜的方法是:( )| A. | Cu+稀HNO3 | B. | Cu$\stackrel{空气、△}{→}$CuO$\stackrel{硝酸}{→}$Cu(NO3)2 | ||
| C. | Cu+浓HNO3 | D. | Cu$\stackrel{Cl_{2}}{→}$CuCl2$\stackrel{AgNO_{3}}{→}$Cu(NO3)2 |
分析 制备硝酸铜,要符合绿色化学的要求方案,应杜绝生成污染性气体,且实验步骤少,消耗原料较少,以此解答该题.
解答 解:A.会生成氮的氧化物,不符合绿色化学的要求,故A错误;
B.生成的氧化铜与硝酸反应生成硝酸铜和水,绿色环保,符合绿色化学的要求,故B正确;
C.会生成氮的氧化物,不符合绿色化学的要求,故C错误;
D.氯气有毒,且不廉价,故D错误.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,侧重绿色化学和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
17.下列说法错误的是( )
| A. | 热化学方程式未注明温度和压强时,△H表示标准状况下的数据 | |
| B. | 热化学方程式中各物质前的化学计量数不表示分子个数,只代表物质的量 | |
| C. | 同一化学反应,化学计量数不同,△H不同;化学计量数相同而状态不同,△H也不相同 | |
| D. | 化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比 |
15.下列说法正确的是( )
| A. | pH=2与pH=1的硝酸中c(H+)之比为1:10 | |
| B. | Na2CO3溶液中c(Na+)与c(CO32-)之比为2:1 | |
| C. | 0.2 mol•L-1与0.1mol/L醋酸中c (H+)之比为2:1 | |
| D. | NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2)之比为3:1 |
12.下表是A、B、C、D、E五种有机物的有关信息:
回答下列问题:
A~E中,属于烃的是AB(填字母).
A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br.
C催化氧化生成D的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
有机物B具有的性质是②③(填序号).
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色.
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成;②球棍模型为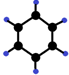 |
| C | ①由C、H、O三种元素组成;②能与Na反应; ③与E反应生成相对分子质量为88的酯 |
| D | ①相对分子质量比C少2;②能由C催化氧化得到 |
| E | ①由C、H、O三种元素组成;②其水溶液能使紫色石蕊试液变红 |
A~E中,属于烃的是AB(填字母).
A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br.
C催化氧化生成D的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
有机物B具有的性质是②③(填序号).
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色.
19.在稀硫酸酸化的H2O2溶液中加入乙醚(C2H5-O-C2H5)后,溶液分层,再加入少量K2Cr2O7溶液,并振荡,在乙醚层中出现深蓝色,这是因为生成2CrO5•(C2H5)2O所致,其反应方程式为:Cr2O72-+4H2O2+2H+═2CrO5+5H2O,已知:CrO5的结构式为: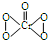 下列说法正确的是( )
下列说法正确的是( )
 下列说法正确的是( )
下列说法正确的是( )| A. | Cr2O72- 被氧化成CrO5 | |
| B. | 该反应为氧化还原反应 | |
| C. | 反应中H2O2被还原成H2O | |
| D. | 此反应用于检验Cr2O72-离子的存在 |
16.一块质量为4g的合金,与足量的盐酸反应完全后生成氢气0.2g,则该合金可能是( )
| A. | 铁镁合金 | B. | 铁铜合金 | C. | 铁锌合金 | D. | 镁铝合金 |
13.下列说法不正确的是( )
| A. | 增大反应物浓度,可增大单位体积内活化分子数,从而使反应速率增大 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器体积),可增加单位体积内活化分子数,从而使反应速率增大 | |
| C. | 活化分子间所发生的碰撞为有效碰撞 | |
| D. | 升高温度能使化学反应速率增大的主要原因是增加了反应物中活化分子数 |
 (1)在有机物:①CH3CH3、②CH2=CH2、③CH3CH2C≡CH、④CH3C≡CCH3、
(1)在有机物:①CH3CH3、②CH2=CH2、③CH3CH2C≡CH、④CH3C≡CCH3、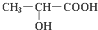 .对于人的身体来说,乳酸是疲劳物质之一,是身体在保持体温和肌体运动而产生热量过程中产生的废弃物.试回答:
.对于人的身体来说,乳酸是疲劳物质之一,是身体在保持体温和肌体运动而产生热量过程中产生的废弃物.试回答: +2Na→
+2Na→ +H2↑,.
+H2↑,.