题目内容
15.加热2.43g Na2CO3和NaHCO3的混合物至质量不再变化,剩余固体2.12g,并将剩余固体配置成200mL的溶液,计算原混合物中Na2CO3的质量.分析 加热时NaHCO3分解,固体质量的变化是NaHCO3分解的缘故,可结合方程式用差量法计算.
解答 解:设混合物中含有xgNaHCO3,
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O△m
2×84g 62g
xg 2.43g-2.12g=0.31g
x=0.84gg,
所以:m(Na2CO3)=2.43g-0.84g=1.59g,
答:原混合物中Na2CO3的质量为1.59g.
点评 本题考查混合物的计算,侧重于学生的分析、计算能力的考查,题目难度不大,注意差量法的运用.

练习册系列答案
相关题目
10. 在室温下,向0.02mol/L的Na2CrO4溶液中滴加0.01mol/L的稀硫酸,溶液由黄色转变成橙红色的Na2Cr2O7,溶液中水Kw增大,在此转化过程中,各物质的量浓度变化如图所示.下列说法正确的是( )
在室温下,向0.02mol/L的Na2CrO4溶液中滴加0.01mol/L的稀硫酸,溶液由黄色转变成橙红色的Na2Cr2O7,溶液中水Kw增大,在此转化过程中,各物质的量浓度变化如图所示.下列说法正确的是( )
 在室温下,向0.02mol/L的Na2CrO4溶液中滴加0.01mol/L的稀硫酸,溶液由黄色转变成橙红色的Na2Cr2O7,溶液中水Kw增大,在此转化过程中,各物质的量浓度变化如图所示.下列说法正确的是( )
在室温下,向0.02mol/L的Na2CrO4溶液中滴加0.01mol/L的稀硫酸,溶液由黄色转变成橙红色的Na2Cr2O7,溶液中水Kw增大,在此转化过程中,各物质的量浓度变化如图所示.下列说法正确的是( )| A. | 向以上反应加入一定量的Na2CO3溶液,对平衡几乎没有影响 | |
| B. | 升高温度,混合溶液的颜色逐渐加深 | |
| C. | 该反应的离子方程式为:2CrO42-+2H+═Cr2O72-+H2O | |
| D. | 该反应的化学平衡常数为5.0x102 |
20.下列反应的离子方程式正确的是( )
| A. | AgOH溶于氨水:AgOH+2NH3•H2O=[Ag(NH3)2]++OHˉ+2H2O | |
| B. | Na2C2O4水解:C2O42-+2H2O=H2C2O4+2OH- | |
| C. | 向NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| D. | 向酸性KMnO4溶液中通入SO2:2MnO4-+5SO2+4OH-=2Mn2++5SO42-+2H2O |
4.0.1mol/L的氨水与0.1mol/L盐酸等体积混合,混合液中各离子浓度关系正确的是( )
| A. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | B. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) | ||
| C. | c(NH4+)=c(Cl-)>c(H+)=c(OH-) | D. | c(NH4+)=c(Cl-)>c(H+)>c(OH-) |
 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二.
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二. 无色,无气味并且易燃.是常见的一种基础能源.
无色,无气味并且易燃.是常见的一种基础能源. 有强氧化性的弱酸,可以用于消毒杀菌.
有强氧化性的弱酸,可以用于消毒杀菌.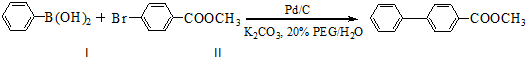

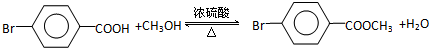 .
. ,
,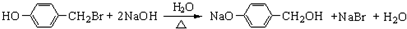
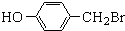
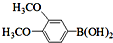 与化合物
与化合物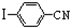 在一定条件可发生类似反应①的反应,其产物的结构简式为
在一定条件可发生类似反应①的反应,其产物的结构简式为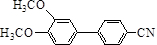 .
.