题目内容
7.如果向10mL、2mol•L-1的稀硫酸里,滴入30mL 1mol•L-1的氢氧化钠溶液,所得溶液呈酸性还是碱性?为什么?分析 根据2NaOH+H2SO4═Na2SO4+2H2O,结合硫酸与氢氧化钠的物质的量计算二者哪种过量,在判断溶液的酸碱性.
解答 解:向10mL、2mol•L-1的稀硫酸里,滴入30mL 1mol•L-1的氢氧化钠溶液,
发生的反应为:2NaOH+H2SO4═Na2SO4+2H2O,n(H2SO4)=2mol•L-1×0.01L=0.02mol,n(NaOH)=1mol•L-1×0.03L=0.03mol,
由方程式可知0.03molNaOH完全反应,消耗0.015mol硫酸,所以硫酸过量,溶液显酸性;
答:溶液显酸性,因为反应后硫酸有剩余.
点评 本题考查了酸碱混合溶液的酸碱性判断,题目难度不大,注意根据反应方程式判断酸碱哪种物质过量,再判断酸碱性.

练习册系列答案
相关题目
18.NA表示阿伏加德罗常数,下列判断正确的是( )
| A. | 18g 18O2 中含有NA个氧原子 | |
| B. | 标准状况下,11.2 L苯中含有分子的数目为0.5NA | |
| C. | 17.6g丙烷中所含的极性共价键为4NA个 | |
| D. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA |
2.FeCl3和CuCl2的混合溶液中加入a g铁粉,待溶液完全变为浅绿色时,滤出不溶物,经干燥后得其质量也是a g,则原溶液中FeCl3和CuCl2的物质的量比是( )
| A. | 1:7 | B. | 2:1 | C. | 2:7 | D. | 7:2 |
12.下列不是离子反应的是( )
| A. | 氢气与氧气点燃生成水 | |
| B. | 硝酸银溶液中加入氯化钠溶液生成白色沉淀 | |
| C. | CuO与稀盐酸反应 | |
| D. | 二氧化碳使澄清石灰水变浑浊 |
19.铝的大规模开发利用比铜大约晚了6000年,主要原因是( )
| A. | 铝在空气中易被氧化,表面形成一层氧化膜 | |
| B. | 铝的性质活泼,不易冶炼;铜的性质不活跃,易于冶炼 | |
| C. | 单质铜的颜色比铝鲜艳,人们喜欢使用 | |
| D. | 氯元素进入人体度人体有害,油漆对人的智力有影响 |
16.某烯烃的结构简式为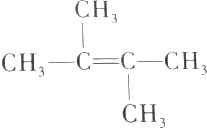 ,下列有关该烯烃分子的叙述中正确的是( )
,下列有关该烯烃分子的叙述中正确的是( )
 ,下列有关该烯烃分子的叙述中正确的是( )
,下列有关该烯烃分子的叙述中正确的是( )| A. | 该烯烃分子中的所有原子都在同一平面上 | |
| B. | 该烯烃分子中有4个碳原子可能在一条直线上 | |
| C. | 该烯烃分子中的6个碳原子不可能都在同一平面上 | |
| D. | 该烯烃与CH2=C(CH2CH3)2互为同分异构体 |
 .
. .
.