题目内容
10.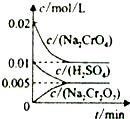 在室温下,向0.02mol/L的Na2CrO4溶液中滴加0.01mol/L的稀硫酸,溶液由黄色转变成橙红色的Na2Cr2O7,溶液中水Kw增大,在此转化过程中,各物质的量浓度变化如图所示.下列说法正确的是( )
在室温下,向0.02mol/L的Na2CrO4溶液中滴加0.01mol/L的稀硫酸,溶液由黄色转变成橙红色的Na2Cr2O7,溶液中水Kw增大,在此转化过程中,各物质的量浓度变化如图所示.下列说法正确的是( )| A. | 向以上反应加入一定量的Na2CO3溶液,对平衡几乎没有影响 | |
| B. | 升高温度,混合溶液的颜色逐渐加深 | |
| C. | 该反应的离子方程式为:2CrO42-+2H+═Cr2O72-+H2O | |
| D. | 该反应的化学平衡常数为5.0x102 |
分析 A、CrO42-在酸性条件下转化为Cr2O72-,存在平衡2CrO42-+2H+?Cr2O72-+H2O,根据影响平衡移动的因素来回答;
B、存在平衡2CrO42-+2H+?Cr2O72-+H2O,溶液颜色由黄色转变成橙红色,根据温度对平衡移动的影响来回答;
C、Na2CrO4溶液中滴加稀硫酸,溶液颜色由黄色转变成橙红色,即铬酸根离子转化为重铬酸根离子;
D、化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值.
解答 解:A、CrO42-在酸性条件下转化为Cr2O72-,存在平衡2CrO42-+2H+?Cr2O72-+H2O,反应加入一定量的Na2CO3溶液,会消耗氢离子,导致平衡逆向移动,故A错误;
B、Na2CrO4溶液中滴加稀硫酸,溶液中水Kw增大,说明反应释放热量,升高温度,平衡逆向移动,混合溶液的颜色逐渐变浅,故B错误;
C、Na2CrO4溶液中滴加稀硫酸,反应的离子方程式为:2CrO42-+2H+=Cr2O72-+H2O,故C正确;
D、CrO42-在酸性条件下转化为Cr2O72-,其反应的方程式为:2CrO42-+2H+?Cr2O72-+H2O;化学平衡常数K=$\frac{c(Cr2O{7}^{2-})}{{c}^{2}(Cr{{O}_{4}}^{-}){c}^{2}({H}^{+})}$=$\frac{5×1{0}^{-3}}{(1×1{0}^{-2})^{4}}$=5×105(mol•L-1)-3,故D错误.
故选C.
点评 本题考查了化学平衡移动原理和应用,题目难度较大,注意掌握平衡常数的计算是关键.

练习册系列答案
相关题目
20.六种短周期元素A、B、C、D、E、F的原子序数依次增大,其中A与E 同主族,B与F 同主族,E与F同周期.已知常温下单质A与E的状态不同,D的核电荷数是B的最外层电子数的2倍,单质F是一种重要的半导体材料.则下列推断中正确的是( )
| A. | A、C两种元素可组成化学式为C2A4的化合物 | |
| B. | E氧化物的水化物有两性 | |
| C. | F与D形成的化合物性质很不活泼,不与任何酸反应 | |
| D. | 元素的非金属性由强到弱的顺序是D>C>F>B |
18.NA表示阿伏加德罗常数,下列判断正确的是( )
| A. | 18g 18O2 中含有NA个氧原子 | |
| B. | 标准状况下,11.2 L苯中含有分子的数目为0.5NA | |
| C. | 17.6g丙烷中所含的极性共价键为4NA个 | |
| D. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA |
5.下列有关物质性质的说法错误的是( )
| A. | 热稳定性:HCl>H2S | B. | 原子半径:N>O | ||
| C. | 结合质子能力:S2->Cl- | D. | 酸性:H2SO3>H2SO4 |
2.FeCl3和CuCl2的混合溶液中加入a g铁粉,待溶液完全变为浅绿色时,滤出不溶物,经干燥后得其质量也是a g,则原溶液中FeCl3和CuCl2的物质的量比是( )
| A. | 1:7 | B. | 2:1 | C. | 2:7 | D. | 7:2 |
19.铝的大规模开发利用比铜大约晚了6000年,主要原因是( )
| A. | 铝在空气中易被氧化,表面形成一层氧化膜 | |
| B. | 铝的性质活泼,不易冶炼;铜的性质不活跃,易于冶炼 | |
| C. | 单质铜的颜色比铝鲜艳,人们喜欢使用 | |
| D. | 氯元素进入人体度人体有害,油漆对人的智力有影响 |