题目内容
4.0.1mol/L的氨水与0.1mol/L盐酸等体积混合,混合液中各离子浓度关系正确的是( )| A. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | B. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) | ||
| C. | c(NH4+)=c(Cl-)>c(H+)=c(OH-) | D. | c(NH4+)=c(Cl-)>c(H+)>c(OH-) |
分析 0.1mol/L氨水和0.1mol/L盐酸等体积混合后,二者恰好反应生成氯化铵,铵根离子部分水解,导致溶液显示酸性:c(H+)>c(OH-),然后结合电荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-)判断溶液中各离子浓度大小.
解答 解:0.1mol/L氨水溶液和0.1mol/L盐酸溶液等体积混合后反应生成氯化铵溶液,铵根离子水解,溶液显示酸性,则:c(H+)>c(OH-),根据电荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-)可得:c(Cl-)>c(NH4+),
所以溶液中离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故选A.
点评 本题考查了离子浓度大小比较、酸碱混合的定性判断,题目难度中等,注意掌握酸碱混合的定性判断方法,能够根据盐的水解、电荷守恒、物料守恒判断溶液中离子浓度大小.

练习册系列答案
 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
12.下列不是离子反应的是( )
| A. | 氢气与氧气点燃生成水 | |
| B. | 硝酸银溶液中加入氯化钠溶液生成白色沉淀 | |
| C. | CuO与稀盐酸反应 | |
| D. | 二氧化碳使澄清石灰水变浑浊 |
19.铝的大规模开发利用比铜大约晚了6000年,主要原因是( )
| A. | 铝在空气中易被氧化,表面形成一层氧化膜 | |
| B. | 铝的性质活泼,不易冶炼;铜的性质不活跃,易于冶炼 | |
| C. | 单质铜的颜色比铝鲜艳,人们喜欢使用 | |
| D. | 氯元素进入人体度人体有害,油漆对人的智力有影响 |
9.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.下列说法正确的是( )
| A. | 元素Y、Z、W形成的简单离子具有相同电子层结构,其离子半径依次增大 | |
| B. | X、Z、R三种元素构成的化合物中只含离子键 | |
| C. | 元素Z、R氧化物对应的水化物之间相互反应,生成的盐溶液只能呈中性 | |
| D. | 元素Y气态氢化物的稳定性强于元素R |
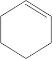
16.某烯烃的结构简式为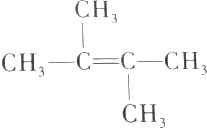 ,下列有关该烯烃分子的叙述中正确的是( )
,下列有关该烯烃分子的叙述中正确的是( )
 ,下列有关该烯烃分子的叙述中正确的是( )
,下列有关该烯烃分子的叙述中正确的是( )| A. | 该烯烃分子中的所有原子都在同一平面上 | |
| B. | 该烯烃分子中有4个碳原子可能在一条直线上 | |
| C. | 该烯烃分子中的6个碳原子不可能都在同一平面上 | |
| D. | 该烯烃与CH2=C(CH2CH3)2互为同分异构体 |
17.下列叙述正确的是(NA表示阿伏伽德罗常数)( )
| A. | 7.8g过氧化钠含有的共用电子对数为0.2NA | |
| B. | 过氧化氢使高锰酸钾溶液褪色,1mol过氧化氢得到2NA电子 | |
| C. | 在含有NH4+、Ba2+、Cl-、NO3-离子的溶液 加入过氧化钠以上各离子量几乎不减少 | |
| D. | 2H2O2(l)═2H2O(l)+O2(g);△H=-98.2 kJ/mol,△S=70.5 J/mol•K,该反应低温能自发进行 |
18.某同学设计如下的元素周期表,下列说法正确的是( )


| A. | X、Y、Z元素分别为N、P、O | |
| B. | 气态氢化物的稳定性:Y>X | |
| C. | 原子半径:Z>X>Y | |
| D. | 1~20号元素中最高价氧化物对应的水化物碱性最强元素在第三周期 |
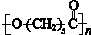 .其合成路线如下.
.其合成路线如下.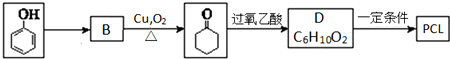

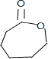 .上述生成D的反应类型是氧化反应.
.上述生成D的反应类型是氧化反应.
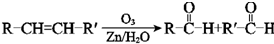
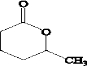 .
. 、XOHCCH2CH2CH2CH2CHO.
、XOHCCH2CH2CH2CH2CHO.