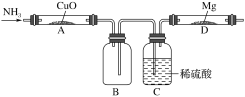
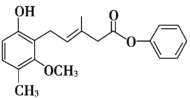
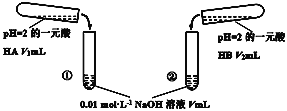
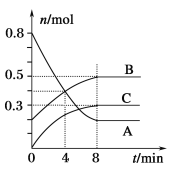
题目内容
【题目】BaSO4在医疗上可作钡餐,高温煅烧BaSO4部分反应如下:
BaSO4(s)+4C(s) BaS(s)+4CO(g) ΔH=+571.2 kJ·mol-1
BaS(s)Ba(s)+S(s) ΔH=+460 kJ·mol-1
已知:2C(s)+O2(g)2CO(g) ΔH=-221 kJ·mol-1
则:Ba(s)+S(s)+2O2(g)BaSO4(s) ΔH=________。
【答案】-1 473.2 kJ·mol-1
【解析】
将已知的热化学方程式依次编号:①BaSO4(s)+4C(s) BaS(s)+4CO(g) ΔH=+571.2 kJ·mol-1,②BaS(s)Ba(s)+S(s) ΔH=+460 kJ·mol-1,③2C(s)+O2(g)2CO(g) ΔH=-221 kJ·mol-1,根据盖斯定律,反应③×2-①-②可得Ba(s)+S(s)+2O2(g)![]() BaSO4(s),据此计算ΔH。
BaSO4(s),据此计算ΔH。
将已知的热化学方程式依次编号:①BaSO4(s)+4C(s) BaS(s)+4CO(g) ΔH=+571.2 kJ·mol-1,②BaS(s)Ba(s)+S(s) ΔH=+460 kJ·mol-1,③2C(s)+O2(g)2CO(g) ΔH=-221 kJ·mol-1,根据盖斯定律,反应③×2-①-②可得Ba(s)+S(s)+2O2(g)![]() BaSO4(s) ΔH=(-221×2-571.2-460) kJ·mol-1=-1 473.2 kJ·mol-1;
BaSO4(s) ΔH=(-221×2-571.2-460) kJ·mol-1=-1 473.2 kJ·mol-1;
故答案为:-1 473.2 kJ·mol-1。

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目