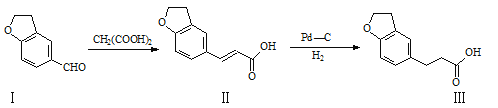
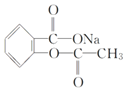
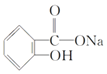
题目内容
【题目】下列酸碱溶液恰好完全中和,如图所示,则下列叙述正确的是( )
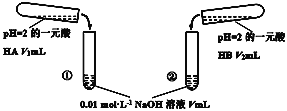
A.因为两种酸溶液的pH相等,故V1一定等于V2
B.若V1>V2,则说明HA为强酸,HB为弱酸
C.若实验①中,V=V1,则混合液中c(Na+)=c(A-)
D.实验②的混合溶液,可能有pH<7
【答案】C
【解析】
pH 均为2的一元酸HA、HB,两种溶液中H+离子浓度相等,酸越弱则酸的浓度越大,与氢氧化钠反应时消耗的体积越小,所以消耗的体积大的酸性较强;若V1>V2,则说明 HA 的酸性比HB的酸性强;若V1=V2,则说明 HA 的酸性与HB的酸性相同;
A.因为不知道两种酸的酸性强弱关系,所以不能判断V1与V2的相对大小,故A错误;
B.由以上分析可知,Vl>V2,则说明 HA 的酸性比HB的酸性强,但无法说明HA是强酸,故B错误;
C.若实验①中,V=V1,说明HA的物质的量浓度也为0.01mol/L,其pH=2,则HA为强酸,反应后溶液显中性,故混合液中c(Na+)=c(A-),故C正确;
D.完全反应后实验②的混合溶液中溶质为强碱弱酸盐或强酸强碱盐,溶液的pH≥7,不可能有pH<7,故D错误;
故答案为C。

练习册系列答案
相关题目