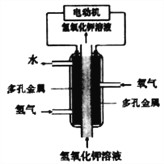
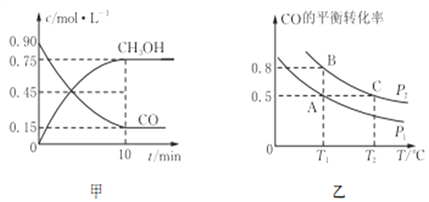
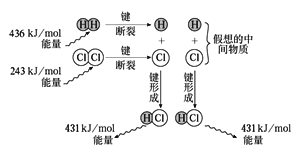
��Ŀ����
����Ŀ����������ĵ���ƽ�ⳣ�����±���
���� | HCOOH | HClO | H2CO3 | H2SO3 |
����ƽ�ⳣ��(25 ��) | Ka��1.77 ��10��4 | Ka��4.0 ��10��8 | Ka1��4.3��10��7 Ka2��4.7��10��11 | Ka1��1.54��10��2 Ka2��1.02��10��7 |
(1)���¶���ͬʱ���������Kaֵ�����Ե����ǿ���Ĺ�ϵΪ________________��
(2)��������0.1 mol��L��1 HCOONa����0.1 mol��L��1 NaClO����0.1 mol��L��1 Na2CO3����0.1 mol��L��1 NaHCO3��Һ��pH�ɴ�С�Ĺ�ϵΪ______________________��
(3)Ũ�Ⱦ�Ϊ0.1 mol��L��1��Na2SO3��Na2CO3�Ļ����Һ�У�SO![]() ��CO
��CO![]() ��HSO
��HSO![]() ��HCO
��HCO![]() Ũ�ȴӴ�С��˳��Ϊ____________________________��
Ũ�ȴӴ�С��˳��Ϊ____________________________��
(4)�������ӷ���ʽ��ȷ����________(����ĸ)��
a��2ClO����H2O��CO2=2HClO��CO![]()
b��2HCOOH��CO![]() =2HCOO����H2O��CO2��
=2HCOO����H2O��CO2��
c��H2SO3��2HCOO��=2HCOOH��SO![]()
d��Cl2��H2O��2CO![]() =2HCO
=2HCO![]() ��Cl����ClO��
��Cl����ClO��
��5�������£�pH��3��HCOOH��Һ��pH��11��NaOH��Һ�������Ϻ���Һ������Ũ���ɴ�С��˳��Ϊ________________________��
���𰸡�(1)KaԽ������Խǿ(2)��>��>��>��
(3)c(SO32��)>c(CO32��)>c(HCO3��)>c(HSO3��)
(4)bd (5)c(HCOO��)>c(Na��)>c(H��)>c(OH��)
��������
�����������1�����¶���ͬʱ���볣��Խ������Խǿ��
��2���¶���ͬʱ���볣��Խ������Խǿ����Խ������Ӧ�����Խ����ˮ�⣬��Ӧ������Һ�ļ���Խǿ������ǿ��˳��ΪHCOOH��H2CO3��HClO��HCO3�����������������Һ��pH�ɴ�С�Ĺ�ϵΪ��>��>��>����
��3������ǿ��˳����H2SO3��H2CO3��HSO3����HCO3�������ˮ��̶���HSO3����HCO3����SO32����CO32��������Ũ�Ⱦ�Ϊ0.1 mol��L��1��Na2SO3��Na2CO3�Ļ����Һ��SO32����CO32����HSO3����HCO3��Ũ�ȴӴ�С��˳��Ϊc(SO32��)>c(CO32��)>c(HCO3��)>c(HSO3��)��
��4��a��������������ǿ��̼���������ClO����H2O��CO2=HClO��HCO3����a����b������������ǿ��̼�ᣬ��2HCOOH��CO32��=2HCOO����H2O��CO2����b��ȷ��c������������ǿ���������������H2SO3��HCOO��=HCOOH��HSO3����c����d��������������ǿ��̼�������������̼�ᣬ��Cl2��H2O��2 CO32��=2 HCO3����Cl����ClO����d��ȷ����ѡbd��
��5�������£�pH��3��HCOOH��Һ��pH��11��NaOH��Һ�������Ϻ�������������Һ����������Һ������Ũ���ɴ�С��˳��Ϊc(HCOO��)>c(Na��)>c(H��)>c(OH��)��

 ���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
���ɶ���ܲ��¿�ֱͨ��Уϵ�д�