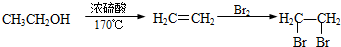题目内容
17.向25℃时的纯水中通入一定量的HCl气体,当溶液的pH=2时,则由水电离出的c(H+)是( )| A. | 1×10-2 mol•L-1 | B. | 1×10-8 mol•L-1 | C. | 1×10-12 mol•L-1 | D. | 1×10-4 mol•L-1 |
分析 25℃时,pH=2的HCl溶液中,氢离子浓度=10-pH,酸性溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度,即水电离出的氢离子浓度=氢氧根离子浓度=$\frac{{K}_{W}}{c({H}^{+})}$.
解答 解:25℃时,pH=2的HCl溶液中,氢离子浓度=10-pH=0.01mol/L,酸性溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度,即水电离出的氢离子浓度=氢氧根离子浓度=$\frac{{K}_{W}}{c({H}^{+})}=\frac{1{0}^{-14}}{0.01}$mol/L=10-12mol/L,故选:C.
点评 本题考查了水的电离,明确酸性溶液中水电离出的氢离子和氢氧根离子的关系即可解答,注意水电离出的氢离子不等于溶液中氢离子,为易错点.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
1.短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与其他三种元素原子的内层电子数相同.X、Y均能与Z分别形成原子个数比为1:1、1:2的气态化合物.根据以上叙述,下列说法不正确的是( )
| A. | 上述气态化合物分子中所有原子最外层电子数均为8 | |
| B. | X、Y、Z都可与W形成既有极性共价键又有非极性共价键的化合物 | |
| C. | 化合物W4XY2Z可能是离子化合物,也可能是共价化合物 | |
| D. | 沸点:W2Z>YW3>XW4 |
5.对于固定体积的密闭容器中进行的气体反应A(g)+B(g)?C(s)+2D(g),可以说明在恒温下已达到平衡状态的是( )
①反应容器中压强不随时间变化而变化
②A气体和B气体的生成速率相等
③混合气体的平均摩尔质量不随时间变化而变化
④反应混合气体的密度不随时间变化而变化.
①反应容器中压强不随时间变化而变化
②A气体和B气体的生成速率相等
③混合气体的平均摩尔质量不随时间变化而变化
④反应混合气体的密度不随时间变化而变化.
| A. | ③④ | B. | ②③ | C. | ①③ | D. | ①④ |
12.既能用浓硫酸,又能用碱石灰干燥的气体是( )
| A. | Cl2 | B. | SO2 | C. | N2 | D. | NH3 |
2.下列关于物质性质的比较,正确的是( )
| A. | NaF、NaCl、NaBr、NaI的熔点依次升高 | |
| B. | 熔点:铯>钾>钠>钠和钾的合金 | |
| C. | 熔沸点:HI>HBr>HCl>HF | |
| D. | 热稳定性:HF>HCl>HBr>HI |
9.下列各式表示水解反应的是( )
| A. | HCO3-+H2O?H3O++CO32- | B. | HS-+H2O?H2S+OH- | ||
| C. | H2PO4-+H2O?HPO42-+H3O+ | D. | HCO3-+OH-?H2O+CO32- |
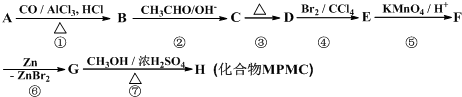
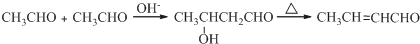
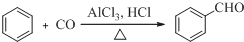
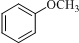 ;D
;D .
.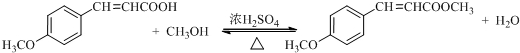 .
. ③CH3CH2CH3 ④HC≡CCH3 ⑤
③CH3CH2CH3 ④HC≡CCH3 ⑤ ⑥CH3CH=CHCH3.
⑥CH3CH=CHCH3.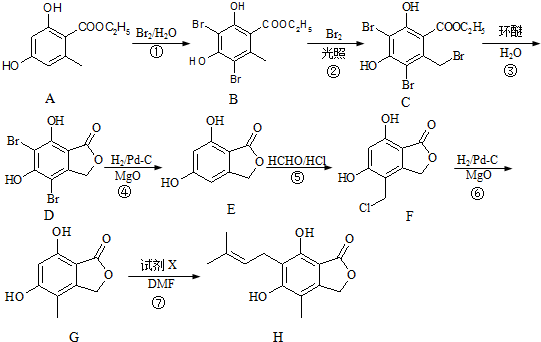
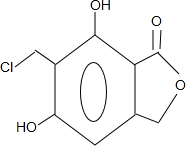 (任写一种).
(任写一种).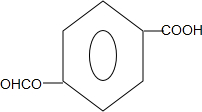 .
.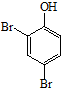 、HCHO为原料制备
、HCHO为原料制备 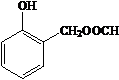 合成路线流程图(无机试剂任用).合成路线流程图示例如下:
合成路线流程图(无机试剂任用).合成路线流程图示例如下: