题目内容
2.中学化学中有很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )| 选项 | 规律 | 结论 |
| A | 强酸可以制弱酸 | 氢硫酸(H2S)无法制取硫酸 |
| B | 反应物浓度越大,反应速度越快 | 常温下,相同的铝片分别加入到浓、稀硫酸中,浓硫酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随着相对分子质量增大而升高 | NH3的沸点低于PH3 |
| D | 溶解 度小的沉淀易向溶解度更小的沉淀转化 | AgCl沉淀中滴定KI溶液,会得到AgI沉淀 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.CuS不溶于硫酸,则硫化氢能够与硫酸铜反应生成硫酸;
B.浓硫酸与铝发生钝化反应,阻止了反应的继续进行;
C.氨气分子之间存在氢键,大大增强了其分子间作用力,导致氨气的沸点大于磷化氢;
D.从难溶电解质的溶解平衡的角度分析.
解答 解:A.硫化氢能够发生反应:H2S+CuSO4=CuS↓+H2SO4,所以硫化氢能够制取硫酸,故A错误;
B.浓硫酸与铝发生钝化反应,在表面生成一层致密的氧化物膜而阻碍反应继续进行,所以稀硫酸中铝片先溶解完,故B错误;
C.一般来讲,结构和组成相似的物质,沸点随着相对分子质量增大而升高,但氨气分子中存在氢键,则NH3的沸点大于PH3,故C错误;
D.AgCl沉淀中滴定KI溶液,由于AgI更难溶,则会实现难溶物转化得到AgI沉淀,故D正确;
故选D.
点评 本题考查探究化学规律,为高频考点,题目难度中等,侧重学生的分析能力的考查,注意把握物质的性质,易错点为C,注意明确氢键对物质沸点的影响,试题培养了学生的分析能力及逻辑推理能力.

练习册系列答案
相关题目
12. 乙酰水杨酸俗称阿司匹林(
乙酰水杨酸俗称阿司匹林( ),是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.实验室以水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:
),是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.实验室以水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:
制备基本操作流程如下:
醋酸酐+水杨酸$\stackrel{浓硫酸}{→}$$\stackrel{摇匀}{→}$$→_{加热}^{85℃-90℃}$$\stackrel{冷却}{→}$$→_{洗涤}^{减压过滤}$粗产品主要试剂和产品的物理常数如表:
回答下列问题:
(1)合成阿司匹林时,最适合的加热方法是水浴加热.
(2)合成阿司匹林时,必须使用干燥的仪器,其原因是防止醋酸酐和水反应.
(3)减压过滤所得粗产品要用少量冰水洗涤,其目的是除去醋酸酐、醋酸、硫酸,并降低乙酰水杨酸的损耗.
(4)用重结晶方法提纯粗产品的流程如下,加热回流装置如图.
粗产品 $→_{沸石}^{乙酸乙酯}$$→_{回流}^{加热}$$\stackrel{趁热过滤}{→}$$→_{加压过滤}^{冷却}$$→_{干燥}^{洗涤}$乙酸水杨酸
①沸石的作用是防暴沸;
②冷凝水的流进方向是a(填“a”或“b”);
③使用温度计的目的是便于调控加热温度,防止乙酰水杨酸分解.
(5)在实验中原料用量:2.0 g水杨酸、5.0 mL醋酸酐(ρ=1.08 g/cm3),最终称得产品质量为2.2 g,则所得乙酰水杨酸的产率为84.3%(精确到0.1).
 乙酰水杨酸俗称阿司匹林(
乙酰水杨酸俗称阿司匹林( ),是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.实验室以水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:
),是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.实验室以水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:
制备基本操作流程如下:
醋酸酐+水杨酸$\stackrel{浓硫酸}{→}$$\stackrel{摇匀}{→}$$→_{加热}^{85℃-90℃}$$\stackrel{冷却}{→}$$→_{洗涤}^{减压过滤}$粗产品主要试剂和产品的物理常数如表:
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 乙酸酐 | 102 | 139.4(沸点) | 反应 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
(1)合成阿司匹林时,最适合的加热方法是水浴加热.
(2)合成阿司匹林时,必须使用干燥的仪器,其原因是防止醋酸酐和水反应.
(3)减压过滤所得粗产品要用少量冰水洗涤,其目的是除去醋酸酐、醋酸、硫酸,并降低乙酰水杨酸的损耗.
(4)用重结晶方法提纯粗产品的流程如下,加热回流装置如图.
粗产品 $→_{沸石}^{乙酸乙酯}$$→_{回流}^{加热}$$\stackrel{趁热过滤}{→}$$→_{加压过滤}^{冷却}$$→_{干燥}^{洗涤}$乙酸水杨酸
①沸石的作用是防暴沸;
②冷凝水的流进方向是a(填“a”或“b”);
③使用温度计的目的是便于调控加热温度,防止乙酰水杨酸分解.
(5)在实验中原料用量:2.0 g水杨酸、5.0 mL醋酸酐(ρ=1.08 g/cm3),最终称得产品质量为2.2 g,则所得乙酰水杨酸的产率为84.3%(精确到0.1).
13.某元素原子的电子排布式是1s22s22p63s23p4,则它在周期表中的位置是( )
| A. | 第2周期第ⅣA族 | B. | 第3周期第ⅣA族 | C. | 第4周期第ⅡA族 | D. | 第3周期第ⅥA族 |
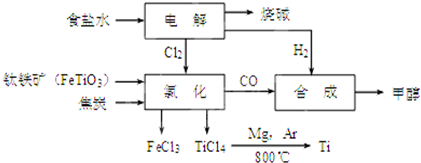
10.钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染.
请回答下列问题:
(1)Fe位于元素周期表中第四周期,第ⅤⅢ族.
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO.
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2•x H2O,再经焙烧制得.水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:发生TiCl4+(2+x)H2O=TiO2•xH2O+4HCl,加入大量水并加热,HCl挥发,促使水解正向进行
(4)反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于1412℃即可.
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数为$\frac{cVM}{10w}$%.(用代数式表示)
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)?CH3OH(g).若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H25mol.

请回答下列问题:
(1)Fe位于元素周期表中第四周期,第ⅤⅢ族.
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO.
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2•x H2O,再经焙烧制得.水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:发生TiCl4+(2+x)H2O=TiO2•xH2O+4HCl,加入大量水并加热,HCl挥发,促使水解正向进行
(4)反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于1412℃即可.
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)?CH3OH(g).若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H25mol.
17.人类生活、生产和社会可持续发展与化学密切相关,下列说法正确的是( )
| A. | 大量燃烧化石燃料排放的废气中含大量CO2、NOx,造成大气污染,从而使雨水的pH=5.6,形成酸雨 | |
| B. | 经过必要的化学变化能从海水中提取粗盐、Mg、Br2等物质 | |
| C. | 针对病毒性流感的扩散情况,要加强环境、个人等的消毒预防,其中消毒剂常选用含氯消毒剂、酒精、双氧水等适宜的物质 | |
| D. | 石油的分馏、石油裂解、煤的气化都包含化学变化 |
7.生活处处有化学.下列说法正确的是( )
| A. | 糖类化合物都具有相同的官能团 | |
| B. | 煎炸食物的花生油和牛油都是可皂化的酯类 | |
| C. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
14.25℃时,下列各组微粒在指定溶液中一定能大量共存的是( )
| A. | 滴加酚酞试液显红色的溶液中:K+、Na+、NO3-、Cl- | |
| B. | c(H+)=1×10-13 mol•L-1的溶液中:Mg2+、Na+、SO42-、NO3- | |
| C. | pH=1的溶液中:Na+、K+、MnO4-、SO2 | |
| D. | 0.1 mol•L-1FeCl3溶液中:Ba2+、Na+、SCN-、Br- |
11.能正确表示下列反应的离子方程式是( )
| A. | Cl2溶于水:Cl2+H2O=2H++Cl-+ClO- | |
| B. | NaHCO3溶液中加入HCl:CO32-+2H+=CO2↑+H2O | |
| C. | 少量二氧化碳通入足量的NaOH溶液:CO2+OH-═HCO3- | |
| D. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O |
 为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如图实验,请回答下列问题:
为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如图实验,请回答下列问题: