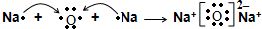题目内容
12.(1)甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+260kJ/mol
已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
则CH4与O2反应生成CO和H2的热化学方程式为2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=-46 kJ/mol
(2)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池.其负极电极反应式是:CH4+10OH--8e-=CO32-+7H2O.
分析 (1)根据盖斯定律,由已知方程式构建目标方程式可得到CH4与O2反应生成CO和H2的热化学反应方程式;
(2)碱性甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应.
解答 解:(1)①CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+260kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
根据盖斯定律,由①×2+②得:2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=-46 kJ/mol,
故答案为:2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=-46 kJ/mol;
(2)碱性甲烷燃料电池,具有还原性的燃料甲烷为原电池的负极,发生氧化反应,电极反应式为CH4+10OH--8e-=CO32-+7H2O,
故答案为:CH4+10OH--8e-=CO32-+7H2O.
点评 本题考查用盖斯定律进行有关反应热的计算、燃料电池的工作原理等知识,注意把握溶液的酸碱性与电极反应,题目难度中等.

练习册系列答案
相关题目
20.下列离子方程式书写正确的是( )
| A. | 过量的SO2通入NaOH溶液中:SO2+2OH-═SO32-+H2O | |
| B. | Fe2O3溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 碳酸氢铵溶液与足量氢氧化钠溶液反应:NH4++OH-═H2O+NH3↑ | |
| D. | 二氧化硫通入溴水中,溴水褪色:SO2+Br2+2H2O═4H++2Br-+SO42- |
17.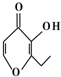 央视焦点访谈节目在2010年10月报道,俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
央视焦点访谈节目在2010年10月报道,俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
 央视焦点访谈节目在2010年10月报道,俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
央视焦点访谈节目在2010年10月报道,俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )| A. | 该有机物遇FeCl3溶液显紫色 | |
| B. | 1mol该有机物最多能与3 mol H2发生加成反应 | |
| C. | 该有机物能发生取代、加成、氧化和消去反应 | |
| D. | 该有机物的一种芳香族同分异构体能发生银镜反应 |
4.化学无处不在,下列与化学有关的说法不正确的是( )
| A. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| B. | 可用蘸浓硫酸的棉棒检验输送氨气的管道是否漏气 | |
| C. | 碘是人体必需微量元素,所以要适量吃富含碘酸根原子团的食物 | |
| D. | 黑火药由硫黄、硝石、木炭三种物质按一定比例混合制成 |
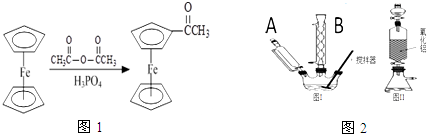
 ),可以使用的仪器分析方法是质谱法(或核磁共振氢谱).(写一种即可)
),可以使用的仪器分析方法是质谱法(或核磁共振氢谱).(写一种即可)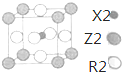 X、Y、Z、W、R是原子序数依次增大的前四周期元素(稀有气体除外).X的基态原子中的电子平均分布在三个不同的能级中;Y的族序数是其周期数的三倍;Z的基态原子核外无未成对电子;W为前四周期中电负性最小的元素;元素R位于周期表的第10列.
X、Y、Z、W、R是原子序数依次增大的前四周期元素(稀有气体除外).X的基态原子中的电子平均分布在三个不同的能级中;Y的族序数是其周期数的三倍;Z的基态原子核外无未成对电子;W为前四周期中电负性最小的元素;元素R位于周期表的第10列.
 .
.