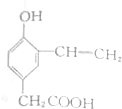
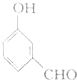
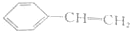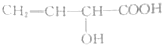题目内容
20.下列离子方程式书写正确的是( )| A. | 过量的SO2通入NaOH溶液中:SO2+2OH-═SO32-+H2O | |
| B. | Fe2O3溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 碳酸氢铵溶液与足量氢氧化钠溶液反应:NH4++OH-═H2O+NH3↑ | |
| D. | 二氧化硫通入溴水中,溴水褪色:SO2+Br2+2H2O═4H++2Br-+SO42- |
分析 A.二氧化硫过量,反应生成亚硫酸氢根离子;
B.铁离子具有氧化性,能够将碘离子氧化成碘单质;
C.强氧化钠足量,铵根离子和碳酸氢根离子都采用反应,漏掉了碳酸氢根离子与氢氧根离子的反应;
D.二氧化硫与溴发生了氧化还原反应生成溴化氢和硫酸.
解答 解:A.过量的SO2通入NaOH溶液中,反应生成亚硫酸氢钠,正确的离子方程式为:SO2+OH-═HSO3-,故A错误;
B.生成的铁离子将碘离子氧化,正确的离子方程式为:2I-+Fe3O4+8H+=3Fe2++4H2O+I2,故B错误;
C.二者反应生成碳酸钠、一水合氨和水,正确的离子方程式为:2OH-+NH4++HCO3-=CO32-+NH3•H2O+H2O,故C错误;
D.二氧化硫通入溴水中,溴水褪色,反应的离子方程式为:SO2+Br2+2H2O═4H++2Br-+SO42-,故D正确;
故选D.
点评 本题考查了离子方程式的正误判断,该题是高考中的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
相关题目
9.下列叙述正确的是( )
| A. | 离子化合物一定不含共价键 | |
| B. | 共价化合物一定不含离子键 | |
| C. | 气态单质的分子中一定存在共价键 | |
| D. | 非金属元素的化合物一定不含离子键 |
11.下列说法错误的是( )
| A. | 乙醇能发生氧化反应而乙酸不能发生氧化反应 | |
| B. | 乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高 | |
| C. | 乙醇和乙酸都是常用调味品的主要成分 | |
| D. | 乙醇和乙酸能发生酯化反应,酯化反应和酯的水解反应互为逆反应 |
15.常温下将amL0.1mol/L CH3COOH溶液和bmL0.1mol/L KOH溶液充分混合,下列判断一定错误的是( )
| A. | 若a<b,c(K+)+c(H+)=c(CH3COO-)+c(OH-) | B. | 若a=b,c(K+)>c(CH3COO-)>c(H+)>c(OH-) | ||
| C. | 若a=b,c(K+)=c(CH3COO-)+c(CH3COOH) | D. | 若a>b,c(CH3COO-)>c(H+)>c(K+)>c(OH-) |
5.下列工业生产过程中,属于应用缩聚反应制取高聚物的是( )
| A. | 单体CH2═CH2制高聚物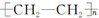 | B. | 单体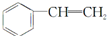 与CH2═CH-CHCH2 与CH2═CH-CHCH2制高聚物 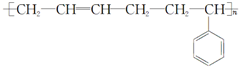 | ||
| C. | 单体CH2═CH-CH3与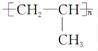 | D. | 单体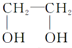 与 与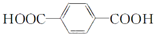 制高聚物 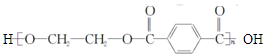 |
9.下列实验方法或叙述正确的是( )
| A. | 用分液漏斗分离水与乙酸的混合物 | |
| B. | 某溶液加氯化钡溶液有白色沉淀生成,说明原溶液中一定有SO42- | |
| C. | 过滤操作时,漏斗下部的尖嘴要紧靠烧杯的内壁 | |
| D. | 从碘水提取碘可用乙醇作萃取剂 |
10.下列实验操作或对实验事实的叙述正确的是( )
| A. | 实验室蒸馏石油时,在蒸馏烧瓶中加入一些碎瓷片,防止暴沸;冷凝管下口进冷水,上口出热水. | |
| B. | 实验室用溴水、苯和铁粉反应制取溴苯,向粗溴苯中加入10%的NaOH溶液进行洗涤,可以除去溶解在溴苯中的溴单质. | |
| C. | 煤是由无机物和有机物组成的复杂混合物,其中含有苯、甲苯、二甲苯等有机物,可以用干馏方法获得苯. | |
| D. | 多数有机反应很慢,往往需要加热,采用水浴加热易控制温度且受热均匀,石油分馏、苯和浓硝酸发生取代反应、银镜反应、油脂水解均必需水浴加热. | |
| E. | 用渗析法分离淀粉中混有的NaN03杂质,用盐析方法提纯蛋白质. |