题目内容
3. X、Y、Z、W、R是原子序数依次增大的前四周期元素(稀有气体除外).X的基态原子中的电子平均分布在三个不同的能级中;Y的族序数是其周期数的三倍;Z的基态原子核外无未成对电子;W为前四周期中电负性最小的元素;元素R位于周期表的第10列.
X、Y、Z、W、R是原子序数依次增大的前四周期元素(稀有气体除外).X的基态原子中的电子平均分布在三个不同的能级中;Y的族序数是其周期数的三倍;Z的基态原子核外无未成对电子;W为前四周期中电负性最小的元素;元素R位于周期表的第10列.(1)X、Y两种元素中电负性较大的元素为O(填元素符号).
(2)化合物XY2分子的空间构型是直线型.
(3)基态R原子的电子排布式为1s22s22p63s23p63d84s2.
(4)化合物ZY的熔点比化合物RY的熔点高,可能的原因是镁离子半径小于镍离子,所以氧化镁的晶格能大于氧化镍.
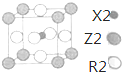
(5)含有X、Z、R三种元素的某种晶体具有超导性,其晶胞结构如图所示.则该晶体中与Z原子紧邻且距离最近的R原子有12个.
分析 X、Y、Z、W、R均为前四周期元素,且原子序数依次增大,X的基态原子中的电子平均分布在三个不同的能级中,则核外电子排布为1s22s22p2,则X为碳元素;Y元素的族序数是其周期数的三倍,只能处于第二周期,则Y为氧元素;W为前四周期中电负性最小的元素,则W为钾元素;Z的基态原子核外无未成对电子,原子序数大于氧小于钾,则核外电子排布为1s22s22p63s2,所以Z为镁元素;元素R位于周期表的第10列,原子序数大于K元素,处于第四周期,R为镍元素,据此解答.
解答 解:X、Y、Z、W、R均为前四周期元素,且原子序数依次增大,X的基态原子中的电子平均分布在三个不同的能级中,则核外电子排布为1s22s22p2,则X为碳元素;Y元素的族序数是其周期数的三倍,只能处于第二周期,则Y为氧元素;W为前四周期中电负性最小的元素,则W为钾元素;Z的基态原子核外无未成对电子,原子序数大于氧小于钾,则核外电子排布为1s22s22p63s2,所以Z为镁元素;元素R位于周期表的第10列,原子序数大于K元素,处于第四周期,R为镍元素,
(1)X为碳元素,Y为氧元素,X、Y两种元素中电负性较大的元素为O,
故答案为:O;
(2)化合物XY2为CO2,分子的空间构型是直线型,
故答案为:直线型;
(3)R为镍元素,是28号元素,根据核外电子排布规律可知其基态原子的电子排布式为1s22s22p63s23p63d84s2,
故答案为:1s22s22p63s23p63d84s2;
(4)化合物ZY为MgO,化合物RY为NiO,由于镁离子半径小于镍离子,所以氧化镁的晶格能大于氧化镍,所以MgO的熔点比NiO的熔点高,
故答案为:镁离子半径小于镍离子,所以氧化镁的晶格能大于氧化镍;
(5)根据晶胞结构图可知,Z位于晶胞的顶点上,与Z原子紧邻且距离最近的R原子位于晶胞中经过Z原子的面的面心上,这样的面有12个,
故答案为:12;
点评 本题是对物质结构的考查,涉及核外电子排布规律、电离能、化学键、晶胞空间结构的判断等,难度中等,推断元素是解题关键,注意晶胞结构的观察.

| A. | 磷对人无毒,除去与否无关紧要 | |
| B. | 含磷的污水是很好的肥料,不必除去 | |
| C. | 含磷污水排到自然水中,引起藻类繁殖,使水变质,必须除去 | |
| D. | 磷是生物的营养元素,不必除去 |
| A. | 乙醇能发生氧化反应而乙酸不能发生氧化反应 | |
| B. | 乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高 | |
| C. | 乙醇和乙酸都是常用调味品的主要成分 | |
| D. | 乙醇和乙酸能发生酯化反应,酯化反应和酯的水解反应互为逆反应 |
| A. | 0.5mol Na完全被氧化生成Na2O2时,转移电子的数目为0.5NA | |
| B. | 0.1molO3中所含氧原子数目为0.2NA | |
| C. | 0.1mol•L-1的NaF溶液中所含F-的数目小于0.1NA | |
| D. | 标准状况下,2.24L CCl4中含有的C-Cl数目为0.4NA |
| A. | 若a<b,c(K+)+c(H+)=c(CH3COO-)+c(OH-) | B. | 若a=b,c(K+)>c(CH3COO-)>c(H+)>c(OH-) | ||
| C. | 若a=b,c(K+)=c(CH3COO-)+c(CH3COOH) | D. | 若a>b,c(CH3COO-)>c(H+)>c(K+)>c(OH-) |

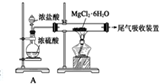 ,其中装置A的作用是制备干燥的HCl气体
,其中装置A的作用是制备干燥的HCl气体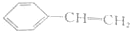
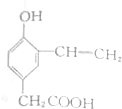
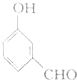

 ;写出聚乙烯的一种用途食品包装袋.
;写出聚乙烯的一种用途食品包装袋.