题目内容
(1)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液中会发生如下反应:Mn2++ S2O82-+H2O→MnO4-+SO42一十H+该反应常用于检验Mn2+的存在。其特征现象是 。若反应中有0.1 mol还原剂参加反应,则消耗氧化剂的物质的量为 mol。
(2)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有 。
(3)将NaBiO3固体(黄色微溶)加入到MnSO3和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应: NaBiO3+ MnSO4+ H2S04→ Na2S04+ Bi2(SO4)3+ NaMnO4+ H2O。
①配平上述反应的化学方程式;
②上述反应中还原产物是 。
③用单线桥表示该氧化还原反应 。
(4)S2O82-在一定条件下,可转变为S2O32-,写出往K2S2O3中滴加稀硫酸的离子方程式: 。
(1)溶液由无色变为紫色;0.25 (2)Cl2 (3) ①10、4、14、3、5、4、14;②Bi2(SO4)3
③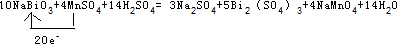
(4)S2O32-+2H+=S↓+SO2↑+H2O
解析试题分析:(1)MnO4-为紫色,其它离子均为无色,则反应的现象为溶液由无色变为紫色;Mn元素的化合价升高,S元素的化合价降低,有0.1mol还原剂(MnSO4)参加反应,则消耗氧化剂的物质的量为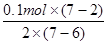 =0.25mol;
=0.25mol;
(2)硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,氯离子可能被氧化,则除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有Cl2;
(3)①Bi元素的化合价由+5价降低为+3价,Mn元素的化合价由+2价升高为+7价,结合电子守恒、原子守恒可知,反应为10NaBiO3+4MnSO4+14H2S04=3Na2S04+5Bi2(SO4)3+4NaMnO4+14H2O,故答案为:10;4;14;3;5;4;14;
②Bi元素的化合价降低,被还原,对应还原产物为Bi2(SO4)3;
③Mn失去电子,Bi得到电子,该反应中转移20e-,用单线桥表示该氧化还原反应为 ;
;
(4)K2S2O3中滴加稀硫酸,发生氧化还原反应生成硫酸钾、S、二氧化硫和水,离子反应为S2O32-+2H+=S↓+SO2↑+H2O,故答案为:S2O32-+2H+=S↓+SO2↑+H2O.
考点:考查氧化还原反应的有关判断与计算

 名校课堂系列答案
名校课堂系列答案在溶液中能大量共存的一组离子或分子是
| A.K+、Al3+、SO42―、NH3·H2O | B.NH4+、H+、NO3―、HCO3― |
C.Na+、CH3COO―、CO32―、OH― | D.Na+、K+、SO32―、Cl2 |
在下列溶液中,各组离子一定能够大量共存的是
| A.pH=2的溶液:Fe3+、Cu2+、SO42-、NO3- |
| B.c(H+)=1×10-12mol/L的溶液:NH4+、K+、Cl-、AlO2- |
| C.水电离的c(H+)=1×10-12mol/L的溶液:Na+、Al3+、Br-、ClO- |
| D.与铝反应放出氢气的溶液:Na+、Mg2+、Br-、Cl- |
下列解释实验事实的反应方程式不正确的是
| A.盛放烧碱的试剂瓶不能用玻璃塞:SiO2+2NaOH=Na2SiO3+H2O |
| B.用烧碱溶液吸收氯气:Cl2+2OH-=Cl-+ClO-+H2O |
C.用KSCN溶液检验Fe3+:Fe3++3SCN- Fe(SCN)3 Fe(SCN)3 |
| D.酸性KI淀粉溶液久置后变蓝:4I-+O2+2H2O=2I2+4OH- |
(18分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能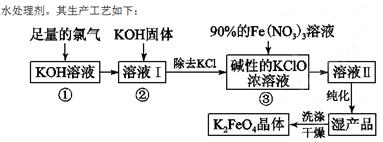
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH与Cl2反应生成的是KClO3。写出在温度较高时KOH与Cl2反应的化学方程式 ,该反应的氧化产物是 。
(2)在溶液Ⅰ中加入KOH固体的目的是 (填编号)。
| A.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供碱性的环境 |
| D.使KClO3转化为KClO |
(4)如何判断K2FeO4晶体已经洗涤干净 。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:
___FeO
 +____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。
+____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。