题目内容
氯气常用于自来水厂杀菌消毒。
(1)工业上用铁电极和石墨做为电极电解饱和食盐水生产氯气,铁电极作 极,石墨电极上的电极反应式为 。
(2)氯氧化法是在碱性条件下,用Cl2将废水中的CN-氧化成无毒的N2和CO2。该反应的离子方程式为 。
(3)氯胺(NH2Cl)消毒法是在用液氯处理自来水的同时通入少量氨气,发生反应:Cl2 + NH3 = NH2Cl + HCl,生成的NH2Cl比HClO稳定,且能部分水解重新生成HClO,起到消毒杀菌的作用。
①氯胺能消毒杀菌的原因是 (用化学用语表示)。
②氯胺消毒法处理后的水中,氮元素多以NH4+的形式存在。
已知:NH4+(aq) + 1.5O2(g)= NO2-(aq) + 2H+(aq) + H2O (l) ΔH=-273 kJ·mol-1
NH4+(aq) + 2O2(g)= NO3-(aq) + 2H+(aq) + H2O (l) ΔH =-346 kJ·mol-1
NO2-(aq)被O2氧化成NO3-(aq)的热化学方程式为 。
(4)在水产养殖中,可以用Na2S2O3将水中残余的微量Cl2除去,某实验小组利用下图所示装置和药品制备Na2S2O3。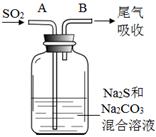

结合上述资料回答:
开始通SO2时,在B口检测到有新的气体生成,判断从B口排出的气体中是否含有H2S,并写出判断依据 。
为获得较多的Na2S2O3,当溶液的pH接近7时,应立即停止通入SO2,其原因是 。
(1)阴 2Cl- - 2e- = Cl2↑
(2)5Cl2 + 2CN- + 4H2O = 10Cl- + N2↑+ 2CO2↑+ 8H +
(3)① NH2Cl+ H2O  NH3 + HClO(不写可逆号扣1分)
NH3 + HClO(不写可逆号扣1分)
② 2NO2- (aq) + O2(g) = 2NO3-(aq) ΔH = -146 kJ·mol-1(反应热写错扣1分)
(4)①答案1:含H2S,由电离常数知H2SO3酸性强于H2S,溶液中的S2-与H2SO3反应生成H2S。
答案2:不含H2S,S2-还原性较强,能被SO2氧化生成其它含硫物质。
(只写“含”或“不含”为0分)
②通入过多SO2会使溶液的pH小于7,S2O32-在酸性溶液中不能稳定存在。
解析试题分析:(1)工业上用铁电极和石墨做为电极电解饱和食盐水生产氯气,铁电极不能做阳极,如果做阳极,Fe-2e-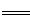 Fe2+,不会得到氯气,所以铁电极作阴极,石墨电极上的电极反应式为2Cl- - 2e- = Cl2↑。
Fe2+,不会得到氯气,所以铁电极作阴极,石墨电极上的电极反应式为2Cl- - 2e- = Cl2↑。
(2)氯氧化法是在碱性条件下,用Cl2将废水中的CN-氧化成无毒的N2和CO2。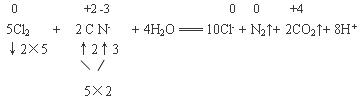
(3)①氯胺能消毒杀菌的原因是发生了水解NH2Cl+ H2O  NH3 + HClO,HClO具有强氧化性,能消毒杀菌。
NH3 + HClO,HClO具有强氧化性,能消毒杀菌。
②NH4+(aq) + 1.5O2(g)= NO2-(aq) + 2H+(aq) + H2O (l) ΔH=-273 kJ·mol-1 ①
NH4+(aq) + 2O2(g)= NO3-(aq) + 2H+(aq) + H2O (l) ΔH =-346 kJ·mol-1 ②
②×2-①×2得NO2-(aq)被O2氧化成NO3-(aq)的热化学方程式为 2NO2- (aq) + O2(g) = 2NO3-(aq) ΔH = -146 kJ·mol-1;
(4)①开始通SO2时,在B口检测到有新的气体生成,判断从B口排出的气体中是否含有H2S,答案1:含H2S,由电离常数知H2SO3酸性强于H2S,溶液中的S2-与H2SO3反应生成H2S。
答案2:不含H2S,S2-还原性较强,能被SO2氧化生成其它含硫物质。
②为获得较多的Na2S2O3,当溶液的pH接近7时,应立即停止通入SO2,其原因是通入过多SO2会使溶液的pH小于7,S2O32-在酸性溶液中不能稳定存在。
考点:本题考查化学综合知识。

由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2+、Ba2+、Cl-、NO2-、SO42-、CO32-。将该混合物溶于水后得澄清溶液,现取4份100 mL该溶液分别进行如下实验:
| 实验 序号 | 实验内容 | 实验结果 |
| A | 加AgNO3溶液 | 有白色沉淀生成 |
| B | 加足量NaOH溶液并加热 | 收集到气体1.12 L(已折算成标准状况下的体积) |
| C | 加足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量沉淀质量为6.27 g,第二次称量沉淀质量为2.33 g |
| D | 加少量KMnO4酸性溶液 | KMnO4溶液褪色 |
试回答下列问题:
(1)根据实验a判断Cl-是否存在________(填“一定存在”、“一定不存在”或“不能确定”)。
(2)该混合物中一定不存在的离子是_______________________________。
(3)①写出实验b中发生反应的离子方程式________。
②写出实验d中使KMnO4酸性溶液褪色的离子方程式________________。
(4)溶液中一定存在的阴离子及其物质的量浓度为(可不填满):
| 阴离子符号 | 物质的量浓度(mol·L-1) |
| | |
| | |
| | |
(5)混合物中是否存在K+?________,判断的理由是__________________。
大气中硫、氮的氧化物是形成酸雨的主要物质。某地酸雨中可能含有下列离子:Na+、Ba2+、NH4+、Al3+、Cl-、SO32-、SO42-、NO3-等。某研究小组取该地一定量的酸雨,浓缩后将所得澄清试液分成三份,进行如下实验:
| 试样 | 所加试剂 | 实验现象 |
| 第一份试液 | 滴加适量的淀粉KI溶液 | 溶液呈蓝色 |
| 第二份试液 | 滴加用盐酸酸化的BaCl2溶液 | 有白色沉淀产生 |
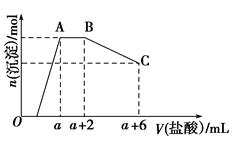
| 第三份试液 | 滴加NaOH溶液,加热,加入的NaOH溶液体积(V)与生成的沉淀、产生的气体的物质的量(n)的关系如右图 | 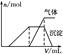 |
请回答下列问题:
(1)根据实验结果判断该酸雨中肯定不存在的离子是______________,不能确定的离子有________________。
(2)写出第一份试液滴加淀粉KI溶液时发生反应的离子方程式:__________________。
(3)第三份试液滴加NaOH溶液,加热,整个过程中发生了多个反应,写出其中两个反应的离子方程式:__________________________________、__________________________。
(4)设计实验方案,检验该酸雨中是否存在Cl-:___________________________________
______________________________。
(5)该小组为了探究NO参与硫酸型酸雨的形成过程,在烧瓶中充入含有少量NO的SO2气体,再慢慢通入O2,发生化学反应后,再喷洒适量蒸馏水即得硫酸型酸雨,则NO在上述反应中的作用是________________________________________________________。
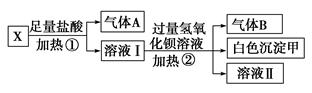
 、
、 、I-和Cl-,取该溶液进行如下实验:
、I-和Cl-,取该溶液进行如下实验: