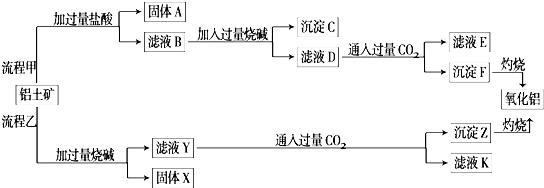
题目内容
13.已知氨气极易溶于水,而难溶于有机溶剂CCl4(密度大于水).下列装置中不适宜作NH3的尾气吸收的是( )| A. |  | B. |  | C. | 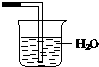 | D. |  |
分析 氨气极易溶于水,吸收氨气时不能直接将导管插入水中,必须使用防止倒吸的装置;常用的方法为:使用倒置的漏斗、使用球形漏斗、使用四氯化碳和水的混合液,据此进行判断.
解答 解:A.氨气不溶于四氯化碳,该装置可以防止倒吸,可用于吸收氨气,故A正确;
B.使用倒置的漏斗,可以防止倒吸,可用于吸收氨气尾气,故B正确;
C.氨气极易溶于水,不能直接将导管插入水中,否则容易发生倒吸,故C错误;
D.球形漏斗可以防止倒吸,可用于吸收氨气尾气,故D错正确.
故选C.
点评 本题考查了常见气体的尾气吸收,题目难度不大,注意明确常见的极易溶于水的气体在尾气吸收时,必须使用防止倒吸的装置,要求学生能够正确判断装置是否具有防止倒吸的作用.

练习册系列答案
相关题目
4.下列可构成原电池装置的是( )
| A. |  | B. |  | C. |  | D. |  |
1.下列物质沸点的比较,错误的是( )
| A. | 丙烷>乙烷 | B. | 丁烷>乙醇 | C. | 苯酚>苯 | D. | 1-氯丙烷>丙烷 |
8.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 1molSiO2晶体内含有2NA个Si-O键 | |
| B. | 在0.1mol熔融KHSO4中,含有0.1NA个SO42- | |
| C. | 在0.5L 1mol•L-1的盐酸中所含粒子总数为NA | |
| D. | 1molSi晶体内含有2NA个Si-Si键 |
18.下列各物质中,按熔点由高到低的顺序排列正确的是( )
| A. | CH4>SiH4>GeH4>SnH4 | B. | KCl>NaCl>MgCl2>MgO | ||
| C. | Rb>K>Na>Li | D. | 金刚石>SiC>Si>S |
5.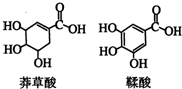 莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物的说法正确的是( )
莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物的说法正确的是( )
 莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物的说法正确的是( )
莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物的说法正确的是( )| A. | 两种酸都能与溴水反应 | |
| B. | 两种酸遇三氯化铁溶液都显色 | |
| C. | 鞣酸分子与莽草酸分子相比多了两个碳碳双键 | |
| D. | 等物质的量的两种酸与足量金属钠反应产生氢气的量不相同 |
2.下列实验能获得成功的是( )
| A. | 苯和浓溴水用铁做催化剂制溴苯 | |
| B. | 甲烷与氯气光照制得纯净的一氯甲烷 | |
| C. | 实验室用CaC2和饱和食盐水制备乙炔 | |
| D. | 将苯与浓硝酸混合共热制硝基苯 |
3.某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.
(1)请完成以下实验设计表(表中不要留空格):
(2)编号①实验测得容器中压强随时间变化如图2.t2时,容器中压强明显小于起始压强,其原因是铁发生了吸氧腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了还原(填“氧化”或“还原”)反应,其电极反应式是O2+2H2O+4e-=4OH-.
(3)经过相当长的一段时间,图1锥形瓶中混合物表面生成了一层红棕色的铁锈,取少量铁锈于试管中,加入稀盐酸,取少量反应之后的溶液检验其中的Fe3+,检验Fe3+最灵敏的试剂是大家熟知的KSCN,可以检验痕量的Fe3+.还可用KI来检验:2Fe3++2I-?2Fe2++I2,有资料认为这可能是一个可逆反应.Fe3+,进而证明这是否是一个可逆反应,试利用实验室常用仪器、用品及以下试剂设计方案并填写位于答题卷的下表.0.1mol/L的FeCl3、KI、KSCN、NaOH、H2SO4、KMnO4溶液,CCl4,蒸馏水.

(1)请完成以下实验设计表(表中不要留空格):
| 编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
| ② | 醋酸浓度的影响 | 0.5 | 36.0 | |
| ③ | 0.2 | 2.0 | 90.0 |
(3)经过相当长的一段时间,图1锥形瓶中混合物表面生成了一层红棕色的铁锈,取少量铁锈于试管中,加入稀盐酸,取少量反应之后的溶液检验其中的Fe3+,检验Fe3+最灵敏的试剂是大家熟知的KSCN,可以检验痕量的Fe3+.还可用KI来检验:2Fe3++2I-?2Fe2++I2,有资料认为这可能是一个可逆反应.Fe3+,进而证明这是否是一个可逆反应,试利用实验室常用仪器、用品及以下试剂设计方案并填写位于答题卷的下表.0.1mol/L的FeCl3、KI、KSCN、NaOH、H2SO4、KMnO4溶液,CCl4,蒸馏水.
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 在试管中加入少量该FeCl3溶液和过量(填少量、过量)的KI溶液. | 深红色如期出现 |
| ② | 将试管中的混合溶液转移至分液漏斗(填仪器)中,倒入一定量的CCl4,塞住活塞,充分振荡(萃取),静置. | 液体分层,上层接近无色,下层紫红色 |
| ③ | 打开活塞,先放出下层液体,再从分液漏斗的上口中倒出水层于试管中,加入KSCN溶液 | 出现血红色,则反应后的混合物中含Fe3+,进而证明这的确是一个可逆反应;反之则不含Fe3+,进而证明不是一个可逆反应 |