题目内容
18.下列各物质中,按熔点由高到低的顺序排列正确的是( )| A. | CH4>SiH4>GeH4>SnH4 | B. | KCl>NaCl>MgCl2>MgO | ||
| C. | Rb>K>Na>Li | D. | 金刚石>SiC>Si>S |
分析 不同晶体的熔点:一般为原子晶体>离子晶体>金属晶体>分子晶体;相同晶体从影响晶体熔沸点高低的因素分析.
解答 解:A.分子结构相似,且都为分子晶体,分子的相对分子质量越大,分子之间作用力越大,熔点越高,则有CH4<SiH4<GeH4,故A错误;
B.离子晶体的晶格能大小取决于离子半径的电荷的因素,离子半径越小,电荷越多,晶格能越大,离子晶体的熔点越高,则有KCl<NaCl<MgCl2<MgO,故B错误;
C.碱金属从上到下,原子半径逐渐增大,金属键键能逐渐减小,金属晶体的熔点逐渐降低,则有Rb<K<Na<Li,故C错误;
D.金刚石、SiC、Si均为原子晶体,键长C-C<C-Si<Si-Si,则熔点为金刚石>SiC>Si,S为分子晶体,熔点最低,故D正确.
故选D.
点评 本题考查晶体熔点的比较,为高频考点,注意把握影响不同晶体熔沸点高低的因素,学习中注重相关基础知识的积累,题目难度不大.

练习册系列答案
相关题目
8.软锰矿(主要成分为Mn02)可用于制备锰及其化合物.
(1)早期冶炼金属锰的一种方法是先缎烧软锰矿生成Mn304,再利用铝热反应原理由Mn3O4制备锰.该铝热反应的化学方程式为8Al+3Mn3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Mn
(2)现代冶炼金属锰的一种工艺流程如图所示:

下表t℃时,有关物质的pKap(注pKap=-1Kap).
①软锰矿还原浸出的反应为:12MnO2+C6H12O6+12H2SO4═12MnSO4+6CO2↑+18H2O
该反应中,还原剂为C6H12O6.写出一种能提高还原浸出速率的措施:升高反应温度或将软锰矿研细等
②滤液1的pH>(填“>”“<”或“=”)MnS04浸出液的pH.
③加入MnF2的目的是除去Ca2+(填“Ca2+”“Fe3+”或“Cu2+”).
(3)由MnS04制取MnC03.往MnS04溶液中加人NH4HC03溶液,析出MnC03沉淀并逸出C02气体,该反应的离子方程式为Mn2++2HCO3-=MnCO3↓+H2O+CO2↑;若往MnS04溶液中加人(NH4)2C03溶液,还会产生Mn(OH) 2,可能的原因有:MnCO3(s)+2OH-(aq)?Mn(OH)2(s)+CO32-(aq),t℃时,该反应的平衡常数K=100(填数值).
(1)早期冶炼金属锰的一种方法是先缎烧软锰矿生成Mn304,再利用铝热反应原理由Mn3O4制备锰.该铝热反应的化学方程式为8Al+3Mn3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Mn
(2)现代冶炼金属锰的一种工艺流程如图所示:

下表t℃时,有关物质的pKap(注pKap=-1Kap).
| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKap | 37.4 | 19.3 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
该反应中,还原剂为C6H12O6.写出一种能提高还原浸出速率的措施:升高反应温度或将软锰矿研细等
②滤液1的pH>(填“>”“<”或“=”)MnS04浸出液的pH.
③加入MnF2的目的是除去Ca2+(填“Ca2+”“Fe3+”或“Cu2+”).
(3)由MnS04制取MnC03.往MnS04溶液中加人NH4HC03溶液,析出MnC03沉淀并逸出C02气体,该反应的离子方程式为Mn2++2HCO3-=MnCO3↓+H2O+CO2↑;若往MnS04溶液中加人(NH4)2C03溶液,还会产生Mn(OH) 2,可能的原因有:MnCO3(s)+2OH-(aq)?Mn(OH)2(s)+CO32-(aq),t℃时,该反应的平衡常数K=100(填数值).
9.根据元素的核电荷数,不能确定的是( )
| A. | 原子核内质子数 | B. | 原子核中子数 | ||
| C. | 原子核外的最外层电子数 | D. | 原子的电子数 |
6.下表中实验“操作和现象”与“结论”对应关系正确的是( )
| 操作和现象 | 结论 | |
| A | 向纯碱中滴加足量浓盐酸,将产生的气体通入苯酚钠溶液,溶液变浑浊 | 酸性:盐酸>碳酸>苯酚 |
| B | 向某溶液中加入新制Cu(OH)2,加热出现红色沉淀 | 证明溶液中一定含醛类物质 |
| C | 取2mL 溴乙烷,加入适量NaOH水溶液,加热.一段时间后,向溶液中滴加AgNO3溶液,有淡黄色沉淀产生 | 溴乙烷中的Br变成了Br- |
| D | 取2mL 溴乙烷,加入适量NaOH乙醇溶液,加热.将产生的气体通入Br2的四氯化碳溶液中,溶液褪色 | 反应生成乙烯,溴乙烷与NaOH乙醇溶液发生消去反应 |
| A. | A | B. | B | C. | C | D. | D |
3.下列说法错误的是( )
| A. | 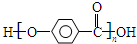 的结构中含有酯基 的结构中含有酯基 | |
| B. | 甲基的电子式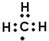 | |
| C. | 顺-2-丁烯和反-2-丁烯的加氢产物不同 | |
| D. | 用重结晶的方法提纯苯甲酸时应趁热过滤 |
10.要检验某溴乙烷中的溴元素,正确的实验方法是( )
| A. | 加入氯水振荡,观察水层是否有红棕色出现 | |
| B. | 滴入AgNO3溶液,再加入稀HNO3,观察有无浅黄色沉淀生成 | |
| C. | 加入NaOH溶液共热,冷却后加入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| D. | 加入NaOH溶液共热,然后加入稀HNO3使溶液呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成 |



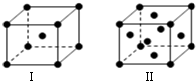 前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2.
前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2. ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③
,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③ 、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.