题目内容
5.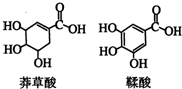 莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物的说法正确的是( )
莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物的说法正确的是( )| A. | 两种酸都能与溴水反应 | |
| B. | 两种酸遇三氯化铁溶液都显色 | |
| C. | 鞣酸分子与莽草酸分子相比多了两个碳碳双键 | |
| D. | 等物质的量的两种酸与足量金属钠反应产生氢气的量不相同 |
分析 A.莽草酸含C=C,鞣酸含酚-OH;
B.莽草酸中不含酚-OH;
C.鞣酸中不含C=C;
D.-OH、-COOH均与Na反应.
解答 解:A.莽草酸含C=C与溴水发生加成反应,鞣酸含酚-OH与溴水发生取代反应,则两种酸都能与溴水反应,故A正确;
B.莽草酸中不含酚-OH,则遇三氯化铁溶液不显紫色,故B错误;
C.鞣酸中不含C=C,莽草酸含1个C=C,故C错误;
D.-OH、-COOH均与Na反应,则等物质的量的两种酸与足量金属钠反应产生氢气的量相同,故D错误;
故选A.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意在有机物中,官能团决定有机物的化学性质,学生要熟记官能团具有的化学性质,并会熟练运用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.我国科学家首次合成的一种过渡金属的新核素${\;}_{72}^{185}$Hf,具有延展性,不易被腐蚀,可应用于高科技领域等特点.185Hf可由180Hf转化而成,下列有关180Hf、185Hf的说法正确的是( )
| A. | 物质的量相等的185Hf与180Hf质量相同 | |
| B. | 核外电子数分别为108、113 | |
| C. | 1 mol 180Hf比1 mol 185Hf的中子数少5NA | |
| D. | 180Hf、185Hf在周期表中的位置不同 |
16.AgCl(s)?Ag++Cl-,平衡时[Ag+][Cl-]=Ksp,过量氯化银分别投入①100mL水 ②24mL0.1mol•L-1NaCl ③10mL 0.1mol•L-1MgCl2 ④30mL 0.1mol•L-1AgNO3溶液中,溶液中[Ag+]从大到小顺序( )
| A. | ③①②④ | B. | ④①②③ | C. | ①②③④ | D. | ④③②① |
20.下列物质的各原子最外层电子数都达到8个电子的是( )
| A. | BeF2 | B. | SiCl4 | C. | CH4 | D. | SF6 |
10.要检验某溴乙烷中的溴元素,正确的实验方法是( )
| A. | 加入氯水振荡,观察水层是否有红棕色出现 | |
| B. | 滴入AgNO3溶液,再加入稀HNO3,观察有无浅黄色沉淀生成 | |
| C. | 加入NaOH溶液共热,冷却后加入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| D. | 加入NaOH溶液共热,然后加入稀HNO3使溶液呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成 |
14.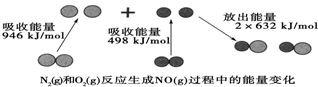 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为1mol N2(g)和1mol O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为1mol N2(g)和1mol O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为1mol N2(g)和1mol O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为1mol N2(g)和1mol O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )| A. | 1mol N2(g)和1mol O2(g)反应放出的能量为180 kJ | |
| B. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| C. | 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量 | |
| D. | 1mol N2(g)和1mol O2(g)具有的总能量大于2mol NO(g)具有的总能量 |
15.如表是稀硫酸与某金属反应的实验数据:
分析上述数据,回答下列问题:
(1)实验4和5表明,固体反应物的表面积对反应速率有影响,能表明同一规律的实验还有1和2(填实验序号);
(2)本实验中影响反应速率的除了浓度还有反应温度,仅表明该因素对反应速率产生影响的实验有6和7(填实验序号).
(3)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:因为所有反应中,金属质量和硫酸溶液体积均相等,且硫酸过量,产生热量相等,故溶液温度变化值相近.
| 实验序号 | 金属 质量/g | 金属状态 | c(H2SO4) /mol•L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
(1)实验4和5表明,固体反应物的表面积对反应速率有影响,能表明同一规律的实验还有1和2(填实验序号);
(2)本实验中影响反应速率的除了浓度还有反应温度,仅表明该因素对反应速率产生影响的实验有6和7(填实验序号).
(3)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:因为所有反应中,金属质量和硫酸溶液体积均相等,且硫酸过量,产生热量相等,故溶液温度变化值相近.