题目内容
通常情况下,NCl3是一种油状液体,其分子空间构型与氨分子相似,下列对NCl3的有关叙述正确的是( )
| A、分子中的所有原子均达到8电子稳定结构 |
| B、分子中N-C1键键长与CCl4分子中C-Cl键键长相等 |
| C、NCl3分子是平面三角形非极性分子 |
| D、NBr3比NCl3易挥发 |
考点:不同晶体的结构微粒及微粒间作用力的区别,化学键,共价键的形成及共价键的主要类型
专题:化学键与晶体结构
分析:A、元素的最外层电子数+元素的化合价的绝对值=8,该元素就达到8电子稳定结构,否则没有达到8电子稳定结构;
B、原子半径越小,原子间形成的键长越短;
C、根据NC13的分子空间构型与氨分子相似;
D、分子晶体中物质的熔沸点与相对分子质量有关,相对分子质量越大,其熔沸点越高,物质的熔沸点越低越容易挥发.
B、原子半径越小,原子间形成的键长越短;
C、根据NC13的分子空间构型与氨分子相似;
D、分子晶体中物质的熔沸点与相对分子质量有关,相对分子质量越大,其熔沸点越高,物质的熔沸点越低越容易挥发.
解答:
解:A、NC13中N原子最外层电子数5+化合价的绝对值3=8,所以N原子达到8电子稳定结构;NC13中C1原子最外层电子数7+化合价的绝对值1=8,所以C1原子达到8电子稳定结构,故A正确;
B、C原子的原子半径大于N原子的原子半径,所以CCl4中C-C1键键长比NC13中N-C1键键长,故B错误;
C、NC13的分子空间构型与氨分子相似,都是三角锥型结构,氨分子是极性分子,所以NCl3分子也是极性分子,故C错误;
D、分子晶体,相对分子质量越大,其熔沸点越高,所以NBr3比NCl3的熔沸点高,NCl3比NBr3易挥发,故D错误.
故选A.
B、C原子的原子半径大于N原子的原子半径,所以CCl4中C-C1键键长比NC13中N-C1键键长,故B错误;
C、NC13的分子空间构型与氨分子相似,都是三角锥型结构,氨分子是极性分子,所以NCl3分子也是极性分子,故C错误;
D、分子晶体,相对分子质量越大,其熔沸点越高,所以NBr3比NCl3的熔沸点高,NCl3比NBr3易挥发,故D错误.
故选A.
点评:本题以信息的形式考查NCl3分子空间结构、分子极性、熔沸点等知识,明确信息并结合所学知识即可解答,题目难度不大.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羰基硫(COS),已知羰基硫分子中所有原子均满足八电子结构,结合周期表知识,有关说法不正确的是( )
| A、羰基硫分子为非极性分子 |
B、羰基硫的电子式为: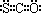 |
| C、羰基硫沸点比CO2高 |
| D、羰基硫分子中三个原子处于同一直线上 |
下列说法正确的是( )
| A、HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱 | ||||
| B、原子最外层电子数为2的元素一定处于元素周期表ⅡA族 | ||||
| C、NaOH和Na2O中所含的化学键类型完全相同 | ||||
D、
|
将2mol A和2mol B通入一密闭容器中,在某温度下达到平衡:2A(g)+B(g)?2C(g)+D(g).经测定,平衡时混合气体中C的体积分数为24%,则B的转化率为( )
| A、73% | B、24% |
| C、36% | D、12% |
下列实验能成功的是( )
| A、将浓硫酸和乙醇混合加热140℃制乙烯 |
| B、用CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热,产生砖红色沉淀 |
| C、CH3CH2Br中滴加AgNO3溶液观察是否有浅黄色沉淀,判断卤代烃的类型 |
| D、苯和浓溴水反应制溴苯 |
在下列分子中,能够在同一个平面内的原子数最多的是( )
| A、甲烷 |
| B、一溴甲烷(CH3Br) |
| C、乙烯 |
| D、CH2=CH-C≡CH |
将2molX和2molY充入2L密闭容器中发生如下反应:X(气)+3Y(气)?2Z(气)+aQ(气),2min达到平衡时生成0.8molZ,测得Q的浓度为0.4mol/L,下列叙述错误是( )
| A、平衡时X的浓度为0.2mol?L-1 |
| B、a的值为2 |
| C、反应速率v(Y)=0.3mol?(L?min)-1 |
| D、Y的转化率为60% |
NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、11g T216O含有的中子数为6NA |
| B、1mol Na2O2与CO2完全反应转移的电子数为2NA |
| C、1mol Na2O2固体中含离子总数为4NA |
| D、标准状况下,2.24L H2O所含共价键数为0.2NA |
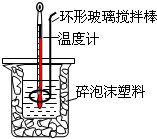 测定中和热实验装置如图:
测定中和热实验装置如图: