题目内容
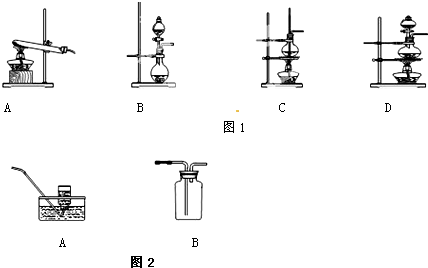
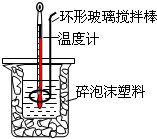 测定中和热实验装置如图:
测定中和热实验装置如图:(1)若实验测得稀溶液中,H+(aq)+OH-(aq)═H2O(1);△H=-57.3kJ/mol
①下列说法正确的是:
A、稀盐酸和稀 NaOH溶液反应的中和热为-57.3kJ/mol
B、稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ/mol
C、浓硫酸与稀NaOH溶液反应的中和热为-57.3kJ/mol
D、稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
②若将NaOH溶液换成Ba(OH)2溶液,经测定向足量的稀硫酸溶液中加入100mL 0.4mol/L Ba(OH)2溶液,放出热量5.12kJ,试通过计算分析此实验中导致中和热变化的原因:
(2)取50mL 0.5mol/L NaOH溶液和30mL 0.5mol/L稀硫酸进行实验,结果如下表所示:
| 温度实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
A.实验装置保温隔热效果差
B.在量取Na0H 溶液的体积时仰视读数
C.分多次把NaOH 溶液倒人盛有硫酸的小烧杯中
D.用温度计测定Na0H溶液的起始温度后直接测定H2S04溶液的温度.
考点:中和热的测定
专题:实验题
分析:(1)①中和热是强酸和强碱的稀溶液完全反应生成1mol水时放出的热量,依据概念对选项分析判断;
②根据热量与物质的量的关系求出反应,然后比较分析即可;
(2)先判断温度差的有效性,然后求出温度差平均值;
先根据Q=m?c?△T计算反应放出的热量,然后根据△H=-
kJ/mol计算出反应热;
A.装置保温、隔热效果差,测得的热量偏小;
B.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高;
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失较多;
D.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高;
②根据热量与物质的量的关系求出反应,然后比较分析即可;
(2)先判断温度差的有效性,然后求出温度差平均值;
先根据Q=m?c?△T计算反应放出的热量,然后根据△H=-
| Q |
| n |
A.装置保温、隔热效果差,测得的热量偏小;
B.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高;
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失较多;
D.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高;
解答:
解:(1)①A、符合中和热的概念,故A正确;
B、符合中和热的概念,故B正确;
C、浓硫酸稀释放热,中和热小于-57.3kJ/mol,故C错误;
D、醋酸是弱电解质,电离过程需要吸热,中和热大于-57.3kJ/mol,故D错误;
故选AB.
②向足量的稀硫酸溶液中加入100mL 0.4mol/L Ba(OH)2溶液,生成水的物质的量为0.1L×0.4mol/L×2=0.08mol,则生成1mol水的反应热为
=64kJ/mol>57.4 kJ/mol,说明Ba2++SO42-=BaSO4也是放热;
故答案为:生成1mol水的反应热为
=64kJ/mol>57.4 kJ/mol,说明Ba2++SO42-=BaSO4也是放热;
(2)4次温度差分别为:4.0℃,6.1℃,3.9℃,4.1℃,第三组数据舍去,三次温度差平均值=
=4.0℃;
50mL 0.5mol/L NaOH溶液和30mL 0.5mol/L稀硫酸溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:80ml×1g/cm3=80g,温度变化的值为△T=4℃,则生成0.025mol水放出的热量为Q=m?c?△T=80g×4.18J/(g?℃)×4.0℃=1337.6J,即1.3376KJ,所以实验测得的中和热△H=-
=-53.5 kJ/mol;
A.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故A正确;
B.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故B错误;
C.分多次把NaOH 溶液倒人盛有硫酸的小烧杯中,热量散失较多,测得温度偏低,中和热的数值偏小,故C正确;
D.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故D正确.
故答案为:4.0;-53.5;ACD
B、符合中和热的概念,故B正确;
C、浓硫酸稀释放热,中和热小于-57.3kJ/mol,故C错误;
D、醋酸是弱电解质,电离过程需要吸热,中和热大于-57.3kJ/mol,故D错误;
故选AB.
②向足量的稀硫酸溶液中加入100mL 0.4mol/L Ba(OH)2溶液,生成水的物质的量为0.1L×0.4mol/L×2=0.08mol,则生成1mol水的反应热为
| 5.12kJ |
| 0.08mol |
故答案为:生成1mol水的反应热为
| 5.12kJ |
| 0.08mol |
(2)4次温度差分别为:4.0℃,6.1℃,3.9℃,4.1℃,第三组数据舍去,三次温度差平均值=
| 4.0℃+3.9℃+4.1℃ |
| 3 |
50mL 0.5mol/L NaOH溶液和30mL 0.5mol/L稀硫酸溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:80ml×1g/cm3=80g,温度变化的值为△T=4℃,则生成0.025mol水放出的热量为Q=m?c?△T=80g×4.18J/(g?℃)×4.0℃=1337.6J,即1.3376KJ,所以实验测得的中和热△H=-
| 1.3376KJ |
| 0.025mol |
A.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故A正确;
B.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故B错误;
C.分多次把NaOH 溶液倒人盛有硫酸的小烧杯中,热量散失较多,测得温度偏低,中和热的数值偏小,故C正确;
D.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故D正确.
故答案为:4.0;-53.5;ACD
点评:本题考查热中和热概念、测定原理及反应热的计算,题目难度大,注意理解中和热的概念以及测定反应热的误差等问题.

练习册系列答案
 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
通常情况下,NCl3是一种油状液体,其分子空间构型与氨分子相似,下列对NCl3的有关叙述正确的是( )
| A、分子中的所有原子均达到8电子稳定结构 |
| B、分子中N-C1键键长与CCl4分子中C-Cl键键长相等 |
| C、NCl3分子是平面三角形非极性分子 |
| D、NBr3比NCl3易挥发 |
下列生活中遇到的问题,不涉及到化学变化的是( )
| A、用CCl4可擦去圆珠笔油渍 |
| B、蜂蚁螯咬处涂抹稀氨水可减痛 |
| C、烹鱼时加入少量食醋和黄酒来调味 |
| D、用食醋来除水壶里的水垢 |
 实验室用乙醇和浓硫酸加热反应制取乙烯,其原理为:
实验室用乙醇和浓硫酸加热反应制取乙烯,其原理为: