题目内容
20.Na2S2O3•5H2O 俗称“海波”,是常用的脱氧剂、定影剂和还原剂;它是无色易溶于水的晶体,不溶于乙醇,在20℃和70℃时的溶解度分别为60.0g和212g,Na2S2O3•5H2O于40~45℃熔化,48℃分解.下面是实验室制备及相关性质实验.制备海波的反应原理:Na2SO3+S $\frac{\underline{\;\;△\;\;}}{\;}$ Na2S2O3
制备海波的流程:
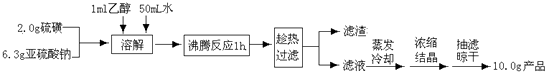
(1)实验开始时用1mL乙醇润湿硫粉的作用是.A
A.有利于亚硫酸钠与硫磺的充分接触 B.防止亚硫酸钠溶解
C.控制溶液的pH D.提高产品的纯度
(2)趁热过滤的原因是.防止温度降低而使Na2S2O3晶体析出.
(3)滤液不采用直接蒸发发结晶的可能原因是直接蒸发结晶易使Na2S2O3•5H2O熔化、分解
(4)抽滤过程中需要洗涤产品晶体,下列液体最适合的是A
A.无水乙醇 B.饱和NaCl溶液 C,水 D.滤掖
(5)产品的纯度测定:取所得产品10.0g,配成500mL溶液,再从中取出25mL溶液于锥形瓶中,滴加几滴淀粉作指示剂,然后用0.050mol/L的标准碘水洛液滴定,重复三次,平均消耗20mL 标准碘水,涉及的滴定反应方程式为:I2+2Na2S2O3═2NaI+Na2S4O6.产品的中Na2S2O3•5H2O的纯度为99.2%
分析 实验室制备海波的流程:S难溶于水,微溶于酒精,实验开始时用lmL乙醇润湿硫粉,有利于亚硫酸钠与硫磺的充分接触,沸腾反应1小时充分反应,Na2SO3+S $\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3,防止温度降低而使Na2S2O3晶体析出,趁热过滤,因Na2S2O3•5H2O含结晶水,防止直接蒸发结晶使Na2S2O3•5H2O熔化、分解,通过蒸发、冷却、浓缩、结晶、抽滤、晾干得到“海波”Na2S2O3•5H2O;
(1)S难溶于水,微溶于酒精,实验开始时用lmL乙醇润湿硫粉,有利于亚硫酸钠与硫磺的充分接触;
(2)温度降低,Na2S2O3的溶解度会减小
(3)由于Na2S2O3•5H2O在40~45℃熔化,48℃分解,直接蒸发结晶,会使产物融化、分解,得不到Na2S2O3•5H2O;
(4)利用Na2S2O3易溶于水,难溶于醇,选择无水乙醇可以降低硫代硫酸钠的损失;
(5)找出关系式 I2~2Na2S2O3求出25mL溶液中含有的Na2S2O3,n(Na2S2O3)=2×n(I2);
解答 解:实验室制备海波的流程:S难溶于水,微溶于酒精,实验开始时用lmL乙醇润湿硫粉,有利于亚硫酸钠与硫磺的充分接触,沸腾反应1小时葱粉反应,Na2SO3+S $\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3,防止温度降低而使Na2S2O3晶体析出,趁热过滤,因Na2S2O3•5H2O含结晶水,防止直接蒸发结晶使Na2S2O3•5H2O熔化、分解,通过蒸发、冷却、浓缩、结晶、抽滤、晾干得到“海波”Na2S2O3•5H2O.
(1)由于S难溶于水,微溶于酒精,实验开始时用lmL乙醇润湿硫粉,有利于亚硫酸钠与硫磺的充分接触,故答案为:A;
(2)若温度降低,Na2S2O3的溶解度会减小,导致Na2S2O3的晶体析出,最后得到的Na2S2O3减少,
故答案为:防止温度降低而使Na2S2O3晶体析出;
(3)由于Na2S2O3•5H2O于40~45℃熔化,48℃分解,若直接蒸发结晶,会使产物融化、分解,得不到Na2S2O3•5H2O,
故答案为:直接蒸发结晶易使Na2S2O3•5H2O熔化、分解;
(4)由于Na2S2O3易溶于水,难溶于醇,选择无水乙醇可以降低硫代硫酸钠的损失,
故答案为:A;
(5)由I2+2Na2S2O3=2NaI+Na2S4O6可知关系式 I2~2Na2S2O3,25mL溶液中含有的Na2S2O3,n(Na2S2O3•5H2O)=2×n(I2)=2×0.05×0.02mol=0.0002mol,配成的500mL溶液中的n(Na2S2O3•5H2O)=0.002×20mol=0.04mol,m(Na2S2O3•5H2O)=0.04×248=9.92g,
产品的中Na2S2O3•5H2O的纯度为:$\frac{9.92}{10.0}$×100%=99.2%,
故答案为:99.2.
点评 本题以实验室制备Na2S2O3•5H2O为载体,考查学生的阅读、分析、理解信息的能力,侧重考查了硫及其化合物的性质,注意(5)利用I2~2Na2S2O3关系式计算,题目难度中等.

 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案| A. | 电解MgCl2饱和溶液可制得金属镁 | |
| B. | 用浓硫酸与铁反应能增大生成H2的速率 | |
| C. | 电解饱和食盐水的过程中,水的电离平衡正向移动 | |
| D. | 纯银器在空气中露置其表面因电化学腐蚀渐渐变暗 |
| 生产过程 | 化学反应 | 反应情况 |
| 硫铁矿的煅烧 | 4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2 | 4%的硫元素损失而混入炉渣 |
| 催化氧化 | 2SO2+O2$?_{△}^{催化剂}$2SO3 | SO2转化率为90% |
| SO3的吸收 | SO3+H2O=H2SO4 | SO3吸收率为100% |
(2)将含Cu与CuO的混合物20.8g加入到50mL 18.4mol•L-1的浓H2SO4中,加热充分反应至固体物质完全溶解,冷却后将混合液稀释至1000mL,测得溶液中c(Cu2+)=0.3mol•L-1.试计算:
①反应放出的气体在标准状况下的体积(不考虑气体的溶解)是4.48L.
②稀释后的溶液中含有的c(H+)是0.84mol/L.
| A. | 称量样品→加热→冷却→称量CuO | |
| B. | 称量样品→加热→冷却→称量Cu(NO3)2 | |
| C. | 称量样品→加NaOH→过滤→加热→冷却→称量CuO | |
| D. | 称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量 |
| A. | SO2、SO3组成元素相同,与H2O反应产物也相同 | |
| B. | 浓硝酸见光会分解,故有时在实验室看到的浓硝酸呈黄色 | |
| C. | CO、NO、NO2都能形成光化学烟雾,是大气污染气体,在空气中都能稳定存在 | |
| D. | 新制氯水显酸性,向新制氯水中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
| A. | 离子化合物一定不含共价键 | |
| B. | 共价化合物一定不含离子键 | |
| C. | 气态单质的分子中一定存在共价键 | |
| D. | 非金属元素的化合物一定不含离子键 |
| A. | 乙醇能发生氧化反应而乙酸不能发生氧化反应 | |
| B. | 乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高 | |
| C. | 乙醇和乙酸都是常用调味品的主要成分 | |
| D. | 乙醇和乙酸能发生酯化反应,酯化反应和酯的水解反应互为逆反应 |


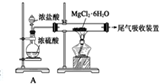 ,其中装置A的作用是制备干燥的HCl气体
,其中装置A的作用是制备干燥的HCl气体