题目内容
5.下列电离方程式中正确的是( )| A. | NaHSO4溶于水:NaHSO4?Na++H++SO42- | |
| B. | 次氯酸电离:HClO═ClO-+H+ | |
| C. | HF溶于水:HF+H2O?H3O++F- | |
| D. | NH4Cl溶于水:NH4++H2O?NH3•H2O+H+ |
分析 A.硫酸氢钠为强电解质,完全电离,用等号;
B.次氯酸为弱电解质,部分电离,用可逆号;
C.氢氟酸为弱电解质,部分电离,在水溶液中电离生成水合氢离子和氟离子;
D.氯化铵为强电解质,完全电离生成氨根离子和氯离子.
解答 解:A.NaHSO4为强电解质溶于水,完全电离,电离方程式:NaHSO4=Na++H++SO42-,故A错误;
B.次氯酸为弱电解质,部分电离,用可逆号:HClO?ClO-+H+,故B错误;
C.氢氟酸为弱电解质,部分电离,电离方程式:HF+H2O?H3O++F-,故C正确;
D.氯化铵电离方程式为:NH4Cl=NH4++Cl-,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,侧重考查盐类的水解和弱电解质的电离,明确电解质的强弱及电离方式是解题关键,题目难度不大.

练习册系列答案
相关题目
15.下列叙述中正确的是( )
| A. | 钠与硫酸铜溶液反应会置换出红色的铜 | |
| B. | 常温下干燥氯气与铁不反应,可以用钢瓶储存液氯 | |
| C. | CO2、NO2、SO2都能与H2O反应,其反应原理相同 | |
| D. | C、N、S三种单质直接与O2反应都能生成两种氧化物 |
16.分子式为C4H10O的醇与C5H10O2的羧酸和浓H2SO4存在时共热生成的酯有( )
| A. | 4种 | B. | 8种 | C. | 12种 | D. | 16种 |
20.已知 和
和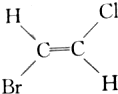 互为同分异构体(顺反异构),则化学式为C3H5Cl的链状化合物的同分异构体共有( )
互为同分异构体(顺反异构),则化学式为C3H5Cl的链状化合物的同分异构体共有( )
 和
和 互为同分异构体(顺反异构),则化学式为C3H5Cl的链状化合物的同分异构体共有( )
互为同分异构体(顺反异构),则化学式为C3H5Cl的链状化合物的同分异构体共有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
17.化学与生活、社会密切相关,下列说法正确的是( )
| A. | 食品添加剂对人体的健康均无害,所以不用严格控制用量 | |
| B. | 棉、麻、丝、毛的主要成分都是纤维素 | |
| C. | 光纤的主要成分是二氧化硅 | |
| D. | 农业施肥所用的碳铵和尿素均属于无机物 |

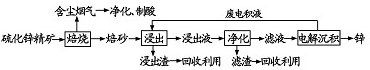
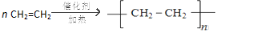 .
.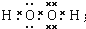 ;将乙加入浅绿色酸性溶液中,溶液变为棕黄色,写出该反应的离子方程式.
;将乙加入浅绿色酸性溶液中,溶液变为棕黄色,写出该反应的离子方程式. .与PH3相比,DC2易液化的主要原因是NH3中有氢键;
.与PH3相比,DC2易液化的主要原因是NH3中有氢键;