题目内容
13.四种元素A、B、C、D,其中A元素原子的原子核内只有一个质子;B的基态原子s能级的总电子数比p能级的总电子数多1;C元素的原子最外层电子数是次外层的3倍; D是形成化合物种类最多的元素.(1)A、D形成的某种化合物甲是一种重要的化工产品,可用作水果和蔬菜的催熟剂,甲分子中σ键和π键数目之比为5:1;写出由甲制高聚物的反应方程式
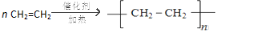 .
.(2)A、C形成的某种化合物乙分子中含非极性共价键,乙分子属于极性分子(“极性分子”或“非极性分子”);其电子式
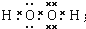 ;将乙加入浅绿色酸性溶液中,溶液变为棕黄色,写出该反应的离子方程式.
;将乙加入浅绿色酸性溶液中,溶液变为棕黄色,写出该反应的离子方程式.(3)写出B的基态原子电子排布图为
 .与PH3相比,DC2易液化的主要原因是NH3中有氢键;
.与PH3相比,DC2易液化的主要原因是NH3中有氢键;(4)笑气(B2C)是一种麻醉剂,有关理论认为B2C与CO2分子具有相似的结构.故B2C的空间构型是直线形,其为非极性(填“极性”或“非极性”)分子.
分析 四种元素A、B、C、D,其中A元素原子的原子核内只有一个质子,则A为H;B的基态原子s能级的总电子数比p能级的总电子数多1,电子排布为1s22s22p3,则B为N;C元素的原子最外层电子数是次外层的3倍,则应为2个电子层,最外层电子数为6,即C为O; D是形成化合物种类最多的元素,D为C元素,以此来解答.
解答 解:依据分析可知A为氢、B为氮、C为氧、D为碳,
(1)A、D形成的化合物甲是一种重要的化工产品,可用作水果和蔬菜的催熟剂,故甲为乙烯,分子式为C2H4,含4个C-H和1个C=C键,则σ键和π键数目之比为5:1;乙烯加聚生成聚乙烯,化学反应方程式为: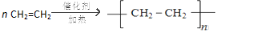 ,故答案为:5:1;
,故答案为:5:1;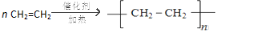 ;
;
(2)A、C形成的化合物A2C2分子的电子式为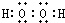 ,属于极性分子,故答案为:极性分子;
,属于极性分子,故答案为:极性分子;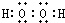 ;
;
(3)B的基态原子电子排布图为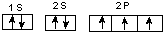 ;与PH3相比,BA3易液化,是因氨气分子之间存在氢键,沸点高易液化,故答案为:
;与PH3相比,BA3易液化,是因氨气分子之间存在氢键,沸点高易液化,故答案为: ;氨气分子之间存在氢键;
;氨气分子之间存在氢键;
(4)N2O与CO2具有相似的结构,应为直线形分子,且存在N=O键,N2O分子中氧原子只与一个氮原子相连,应为N=N=O结构,氮和氮原子之间的化学键是非极性共价键,故答案为:直线型,非极性.
点评 本题考查位置、结构、性质的关系及应用,为高频考点,把握原子结构、电子排布推断元素为解答的关键,侧重物质结构与性质的考查及分析、推断能力的考查,题目难度不大.

练习册系列答案
相关题目
5.下列电离方程式中正确的是( )
| A. | NaHSO4溶于水:NaHSO4?Na++H++SO42- | |
| B. | 次氯酸电离:HClO═ClO-+H+ | |
| C. | HF溶于水:HF+H2O?H3O++F- | |
| D. | NH4Cl溶于水:NH4++H2O?NH3•H2O+H+ |
4.为了确定某样品是否被氧化,所选试剂(括号内物质)不正确的是( )
| A. | FeCl2(NH4SCN溶液) | B. | KI(淀粉溶液) | ||
| C. | 白磷(紫色石蕊试液) | D. | Na2SO3( BaCl2 溶液) |
8.下列说法中正确的是( )
| A. | 非金属原子间以共价键结合的物质都是共价化合物 | |
| B. | 由不同原子所形成的纯净物一定是化合物 | |
| C. | 含有金属元素的离子不一定是阳离子 | |
| D. | 离子化合物一定能导电 |
18.小组同学查阅资料,得到了Na2CO3(aq)与盐酸反应过程中的能量变化示意图如下.下列说法错误的是( )

(注:碳酸钠与碳酸氢钠的溶解过程的热效应忽略不计)

(注:碳酸钠与碳酸氢钠的溶解过程的热效应忽略不计)
| A. | △H1<△H2 | |
| B. | 若反应HCO3-+H+=CO2↑+H2O的熵增效应大于吸热效应,则其在常温常下能自发进行 | |
| C. | CO32-(aq)+2H+(aq)=CO2(g)+H2O(l)△H=(△H1+△H2-△H3) kJ/mol | |
| D. | 相同条件下,结合H+的能力:CO32->HCO3- |
5.化学中常用图象直观地描述化学反应的进程或结果.下列图象描述正确的是( )
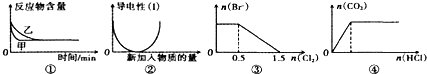

| A. | 图①标上压强可对逆反应2A(g)+2B(g)?3C(g)+D(g)的影响,乙的压强大 | |
| B. | 图②表示向乙酸溶液中通入氨气至过量的过程,溶液导电性变化 | |
| C. | 图③表示在1L1mol/LFeBr2溶液中通入Cl2时Br-的量的变化 | |
| D. | 图④表示一定浓度Na2CO3溶液中逐滴滴加盐酸与生成CO2的物质的量的关系 |
2.下列说法中正确的是( )
| A. | 分子式为C4H9Cl的物质一共有4种结构 | |
| B. | 可以用酸性KMnO4溶液除去甲烷中的乙烯 | |
| C. | 2,2-二甲基丙烷中所有碳原子在同一平面上 | |
| D. | CH3-CH=CH-CH3与HCl发生加成反应,产物有两种 |
3. 下列①②对应的试剂(或条件)不能完成实验目的是( )
下列①②对应的试剂(或条件)不能完成实验目的是( )
 下列①②对应的试剂(或条件)不能完成实验目的是( )
下列①②对应的试剂(或条件)不能完成实验目的是( )| 实验目的 | 试剂(或条件) | |
| A | 温度对Na2S2O3与H2SO4反应速率的影响 | ①热水浴②冷水浴 |
| B | 用Na块检验乙醇分子存在不同与烃分子里的氢原子 | ①乙醇②煤油 |
| C | 用酸化的AgNO3溶液检验来自水中Cl-能否蒸馏除去 | ①自来水②蒸馏水 |
| D | 用溴水检验苯的同系物种取代基对苯活性有影响 | ①苯②甲苯 |
| A. | A | B. | B | C. | C | D. | D |
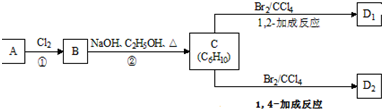
 .
.