题目内容
13.已知化合物A既能与盐酸反应产生气体,又能与氢氧化钠反应产生气体.在一定条件下,A能实现下列转化:
(1)A的化学式可能为(NH4)2S或NH4HS.
(2)当X为盐酸时,E与Cu反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.当X为氢氧化钠溶液时,E与Cu反应的化学方程式为3Cu+8HNO3(稀)═3Cu(NO3)2+2NO2↑+4H2O.
(3)B与C可以发生归中反应生成一种单质,B与D也可以发生归中反应生成单质,试写出其中任意一个反应的化学方程式2H2S+SO2═3S↓+2H2O或8NH3+6NO2=7N2+12H2O.
分析 化合物A既能与盐酸反应产生气体,说明A中有弱酸根离子,又能与氢氧化钠反应产生气体,说明A中有铵根离子,B可以连续两次与Y反应生成C和D,B与C可以发生归中反应生成一种单质,B与D也可以发生归中反应生成单质,则A中应含有硫元素,且是低价的硫,可以连续被氧化,所以A可以是(NH4)2S 或 NH4HS,Y为氧气,Z为水,若X是碱,则B为氨气,C为一氧化氮,D为二氧化氮,E为硝酸,若X为酸时,则B为硫化氢,C为二氧化硫,D为三氧化硫,E为硫酸,据此答题.
解答 解:化合物A既能与盐酸反应产生气体,说明A中有弱酸根离子,又能与氢氧化钠反应产生气体,说明A中有铵根离子,B可以连续两次与Y反应生成C和D,B与C可以发生归中反应生成一种单质,B与D也可以发生归中反应生成单质,则A中应含有硫元素,且是低价的硫,可以连续被氧化,所以A可以是(NH4)2S 或 NH4HS,Y为氧气,Z为水,若X是碱,则B为氨气,C为一氧化氮,D为二氧化氮,E为硝酸,若X为酸时,则B为硫化氢,C为二氧化硫,D为三氧化硫,E为硫酸,
(1)根据上面的分析可知,A可以是(NH4)2S 或 NH4HS,
故答案为:(NH4)2S 或 NH4HS;
(2)当X为盐酸时,E为硫酸,E与Cu反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O,当X为氢氧化钠溶液时,E为硝酸,E与Cu反应的化学方程式为3Cu+8HNO3(稀)═3Cu(NO3)2+2NO2↑+4H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O;3Cu+8HNO3(稀)═3Cu(NO3)2+2NO2↑+4H2O;
(3)B与C可以发生归中反应生成一种单质,B与D也可以发生归中反应生成单质,则其中任意一个反应的化学方程式为2H2S+SO2═3S↓+2H2O 或8NH3+6NO2=7N2+12H2O,
故答案为:2H2S+SO2═3S↓+2H2O 或8NH3+6NO2=7N2+12H2O.
点评 本题考查了物质转化关系,物质性质的分析判断,物质之间的相互转化是解题关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | n+11 | B. | n-5 | C. | n+3 | D. | n-6 |
| A. | NiMH 电池放电过程中,正极的电极反应式为:NiOOH+H2O+e-=Ni(OH)2+OH- | |
| B. | 充电过程中OH-离子从阳极向阴极迁移 | |
| C. | 充电过程中阴极的电极反应式:H2O+M+e-=MH+OH-,H2O中的H被M还原 | |
| D. | 放电是OH-离子从正极向负极迁移 |
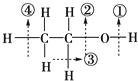
| A. | 与金属钠反应时键①断裂 | |
| B. | 与乙酸发生酯化反应时键①断裂 | |
| C. | 与浓硫酸共热到170℃时键③、④断裂 | |
| D. | 在铜催化下与氧气反应时键①、③断裂 |
①NO和SO3 的物质的量一定相等
②NO2和SO2的物质的量一定相等
③体系中的总物质的量一定等于反应开始时总物质的量
④SO2、NO2、NO、SO3 的物质的量一定相等.
| A. | ①和② | B. | ②和③ | C. | ①和③ | D. | ③和④ |
| A. | NaHSO4溶于水:NaHSO4?Na++H++SO42- | |
| B. | 次氯酸电离:HClO═ClO-+H+ | |
| C. | HF溶于水:HF+H2O?H3O++F- | |
| D. | NH4Cl溶于水:NH4++H2O?NH3•H2O+H+ |
| A. | 按系统命名法,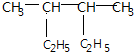 的名称是2,3-二乙基丁烷 的名称是2,3-二乙基丁烷 | |
| B. | 主链有4个碳原子,且总碳原子数≤6的烷烃共有10种 | |
| C. | 结构片段为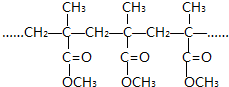 的高聚物,是由其单体通过缩聚反应生成的 的高聚物,是由其单体通过缩聚反应生成的 | |
| D. | 等质量的乙烯和聚乙烯完全燃烧,产生的二氧化碳的质量比为1:1 |
 A~G为原子序数依次增大的短周期主族元素,A原子与其他元素不处于同一周期,元素B的基态原子核外电子共有6种运动状态,D、F同族,D原子的基态原子价电子排布式均为ns2npn+2,E元素所在周期中,E气态基态原子的第一电离能力最小,试回答下列问题:(均用元素符号表示).
A~G为原子序数依次增大的短周期主族元素,A原子与其他元素不处于同一周期,元素B的基态原子核外电子共有6种运动状态,D、F同族,D原子的基态原子价电子排布式均为ns2npn+2,E元素所在周期中,E气态基态原子的第一电离能力最小,试回答下列问题:(均用元素符号表示).
 .
.