题目内容
10.配平“浸出”步骤中发生反应的化学方程式:C6H12O6+12MnO2+12H2SO4═12MnSO4+6CO2↑+18H2O.
分析 反应中C6H12O6中的C由0价升高到CO2中的+4价,MnO2中的Mn由+4价降低到MnSO4中+2价,依据氧化还原反应化合价升降数目相等可知1molC6H12O6反应碳原子共失去24个电子,需要二氧化锰的物质的量为12mol,依据原子个数守恒配平书写方程式.
解答 解:应中C6H12O6中的C由0价升高到CO2中的+4价,MnO2中的Mn由+4价降低到MnSO4中+2价,依据氧化还原反应化合价升降数目相等可知1molC6H12O6反应碳原子共失去24个电子,需要二氧化锰的物质的量为12mol,依据原子个数守恒,该反应方程式为:C6H12O6+12 MnO2+12H2SO4=12 MnSO4十6CO2十18H2O,
故答案为:12;12;12;6;18.
点评 本题考查了氧化还原反应方程式的配平,明确氧化还原反应得失电子守恒是解题关键,注意遵循原子个数守恒规律.

练习册系列答案
相关题目
1.乙醇分子中各种化学键如图所示.关于乙醇在下列反应中断键情况的说法中不正确的是( )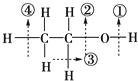

| A. | 与金属钠反应时键①断裂 | |
| B. | 与乙酸发生酯化反应时键①断裂 | |
| C. | 与浓硫酸共热到170℃时键③、④断裂 | |
| D. | 在铜催化下与氧气反应时键①、③断裂 |
5.下列电离方程式中正确的是( )
| A. | NaHSO4溶于水:NaHSO4?Na++H++SO42- | |
| B. | 次氯酸电离:HClO═ClO-+H+ | |
| C. | HF溶于水:HF+H2O?H3O++F- | |
| D. | NH4Cl溶于水:NH4++H2O?NH3•H2O+H+ |
15.向a mol BaCl2、AlCl3和FeCl3的混合液A中,逐滴加入Na2SO4和NaOH的混合液B,产生沉淀的物质的量n与加入溶液B的体积关系如图所示,下列叙述正确的是( )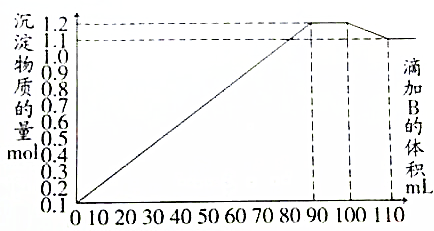

| A. | 加入90mL B时,A溶液中金属离子沉淀完全 | |
| B. | 加入110mL B时,沉淀物仅为BaSO4 | |
| C. | B溶液中Na2SO4和NaOH的物质的量浓度之比为1:1 | |
| D. | 当溶液中含有NaAlO2时,加入溶液B的体积V(B)≥100mL |
2.下列说法正确的是( )
| A. | 按系统命名法,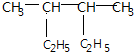 的名称是2,3-二乙基丁烷 的名称是2,3-二乙基丁烷 | |
| B. | 主链有4个碳原子,且总碳原子数≤6的烷烃共有10种 | |
| C. | 结构片段为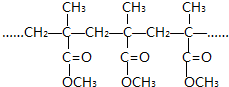 的高聚物,是由其单体通过缩聚反应生成的 的高聚物,是由其单体通过缩聚反应生成的 | |
| D. | 等质量的乙烯和聚乙烯完全燃烧,产生的二氧化碳的质量比为1:1 |
17.化学与社会、生产、生活紧切相关,下列说法正确的是( )
| A. | 信息产业中的光缆的主要成份是单质硅 | |
| B. | NO2、CO2、SO2、PM2.5颗粒都会导致酸雨 | |
| C. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 | |
| D. | 发酵粉能使焙制出的糕点疏松多孔,是因为发酵粉中含有碳酸氢钠 |
18.小组同学查阅资料,得到了Na2CO3(aq)与盐酸反应过程中的能量变化示意图如下.下列说法错误的是( )

(注:碳酸钠与碳酸氢钠的溶解过程的热效应忽略不计)

(注:碳酸钠与碳酸氢钠的溶解过程的热效应忽略不计)
| A. | △H1<△H2 | |
| B. | 若反应HCO3-+H+=CO2↑+H2O的熵增效应大于吸热效应,则其在常温常下能自发进行 | |
| C. | CO32-(aq)+2H+(aq)=CO2(g)+H2O(l)△H=(△H1+△H2-△H3) kJ/mol | |
| D. | 相同条件下,结合H+的能力:CO32->HCO3- |
 A~G为原子序数依次增大的短周期主族元素,A原子与其他元素不处于同一周期,元素B的基态原子核外电子共有6种运动状态,D、F同族,D原子的基态原子价电子排布式均为ns2npn+2,E元素所在周期中,E气态基态原子的第一电离能力最小,试回答下列问题:(均用元素符号表示).
A~G为原子序数依次增大的短周期主族元素,A原子与其他元素不处于同一周期,元素B的基态原子核外电子共有6种运动状态,D、F同族,D原子的基态原子价电子排布式均为ns2npn+2,E元素所在周期中,E气态基态原子的第一电离能力最小,试回答下列问题:(均用元素符号表示).