题目内容
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需能量(kJ)是( )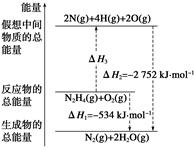
| A.194 | B.391 | C.516 | D.658 |
B
解析试题分析: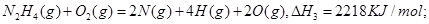 设断裂1 mol N—H键所需能量为x,则有:154+4x+500=2218,解的x=391,所以B正确。
设断裂1 mol N—H键所需能量为x,则有:154+4x+500=2218,解的x=391,所以B正确。
考点:化学反应中的能量变化。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案知:① 2C(已s)+O2(g) =2CO(g) 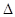 H= -221.0kJ/mmol
H= -221.0kJ/mmol
②2H2(g) + O2(g) =2H2O(g) 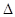 H= -483.6kJ/ol。
H= -483.6kJ/ol。
则制备水煤气的反应 C(s) +H2O(g) = CO(g) + H2(g)的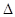 H为
H为
| A.+262.6kJ/mol | B.-131.3kJ/mol | C.-352.3kJ/mol | D.+131.3kJ/mol |
已知H2O(g)= H2O(l) △H1=Q1 kJ/mol
C2H5OH(g) = C2H5OH(l), △H2=Q2 kJ/mol
C2H5OH(g)+3O2(g) =2CO2(g) + 3H2O(g), △H3=Q3 kJ/mol
若使用23 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )kJ
| A.Q1 +Q2 +Q3 | B.0.5(Q1 +Q2 +Q3) |
| C.0.5Q1 –0.5Q2 +0.5Q3 | D.1.5Q1 –0.5Q2 +0.5Q 3 |
下列与化学反应能量变化相关的叙述正确的是( )
| A.生成物总能量一定低于反应物总能量 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
下列有关热化学方程式的叙述中,正确的是 ( )
| A.含20.0g NaOH的稀溶液与足量的稀硫酸完全中和,放出28.7kJ的热量,则表示中[和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-114.8kJ/mol |
B.已知热化学方程式:SO2(g)+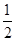 O2(g) O2(g) SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ |
| C.已知2H2(g)+O2(g)=2H2O(g); △H=-483.6kJ/mol,则H2的燃烧热为241.8kJ/mol |
| D.已知①S(s)+O2(g)=SO2(g); △H1②S(g)十O2(g)=SO2(g);△H2 则△H1>△H2 |
有关能量的判断或表示方法正确的是 ( )
| A.由:H+(aq) + OH-(aq)= H2O(l)△H =-57.3kJ/mol,可知:含1mol CH3COOH的溶液与含1mol NaOH的溶液混合,放出热量等于57.3 kJ |
| B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
| C.从C(石墨)= C(金刚石)△H =" +" 1.9kJ/mol,可知石墨比金刚石更稳定 |
| D.2gH2完全燃烧生成液态水放出285.8kJ热量,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)="2" H2O(l)△H =-285.8kJ/mol |
有关能量的判断或表示方法正确的是
| A.由:H+(aq) + OH-(aq) = H2O(l)△H = -57.3kJ/mol,可知:含0.5mol H2SO4的浓溶液与含1molNaOH的溶液混合,放出热量大于57.3 kJ |
| B.从C(石墨)= C(金刚石) △H =" +" 119kJ/mol,可知:金刚石比石墨更稳定 |
| C.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
| D.没有单质参加的化合反应可能为氧化还原反应,也可能为放热反应 |
强酸与强碱在稀溶液中发生中和反应的热化学方程式为H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,向3份同体积0.2 mol ·L-1的NaOH溶液中分别加入适量的稀醋酸、浓硫酸、稀硝酸,恰好完全反应的热效应ΔH1、ΔH2、ΔH3的关系正确的是 ( )
| A.ΔH1>ΔH2>ΔH3 | B.ΔH2>ΔH3>ΔH1 |
| C.ΔH2>ΔH1>ΔH3 | D.ΔH1>ΔH3>ΔH2 |
已知下列反应的热化学方程式为
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
(2)C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol
(3)H2(g)+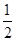 O2(g)=H2O(l) ΔH3=-285.8 kJ/mol
O2(g)=H2O(l) ΔH3=-285.8 kJ/mol
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的ΔH为( )
| A.-488.3 kJ/mol | B.-191 kJ/mol | C.-476.8 kJ/mol | D.-1 549.6 kJ/mol |