题目内容
有关能量的判断或表示方法正确的是
| A.由:H+(aq) + OH-(aq) = H2O(l)△H = -57.3kJ/mol,可知:含0.5mol H2SO4的浓溶液与含1molNaOH的溶液混合,放出热量大于57.3 kJ |
| B.从C(石墨)= C(金刚石) △H =" +" 119kJ/mol,可知:金刚石比石墨更稳定 |
| C.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
| D.没有单质参加的化合反应可能为氧化还原反应,也可能为放热反应 |
A
解析试题分析:A. H2SO4的浓溶液在反应时与水会放出热量,故正确;B.从C(石墨)= C(金刚石) △H =" +" 119kJ/mol,可知:正反应是吸热反应,金刚石的能量比较高,比石墨不稳定,错误;C.由于硫固体在燃烧时首先要转化为硫蒸气,这个过程需要吸热,故等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更少才对,错误;D.没有单质参加的化合反应一定不是氧化还原反应,故错误;
考点:本题考查通过反应热判断物质的稳定性和热量的多少。

 阅读快车系列答案
阅读快车系列答案肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
①N2(g) + 2O2(g) ="2" NO2(g) ΔH = +67.7kJ/mol
②2N2H4(g) + 2NO2(g) =3N2(g) + 4H2O (g) ΔH = -1135.7kJ/mol
下列说法正确的是
| A.N2H4(g) + O2(g) = N2(g) + 2H2O(g)ΔH = -1068 kJ/mol |
| B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O = N2H5+ + OH- |
| C.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,放电时的负极反应式:N2H4-4e- + 4OH- = N2 + 4H2O |
| D.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,工作一段时间后,KOH溶液的pH将增大 |
下列措施不能达到节能减排目的的是( )
| A.利用太阳能制氢燃料 | B.用家用汽车代替公交车 |
| C.利用潮汐能发电 | D.用节能灯代替白炽灯 |
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需能量(kJ)是( )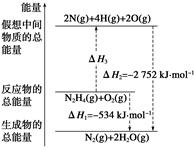
| A.194 | B.391 | C.516 | D.658 |
下列热化学方程式正确的是(△H的绝对值均正确)( )
| A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ; ΔH=-1 367.0 kJ·mol-1(燃烧热) |
| B.Ba(OH)2(aq)+2HCl(aq)=BaCl2(aq)+2H2O(l); ΔH=-57.3 kJ·mol-1(中和热) |
| C.S(s)+O2(g)=SO2(g); ΔH=-269.8 kJ·mol-1(反应热) |
| D.2NO2=O2+2NO; ΔH=+116.2 kJ·mol-1(反应热) |
、下列反应中生成物总能量高于反应物总能量的是
| A.氧化钙溶于水 | B.乙醇燃烧 | C.铝粉与氧化铁粉末反应 | D.碳酸钙受热分解 |
已知298 K时,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,推测含1 mol HCl的稀溶液与含1 mol NH3的稀溶液反应放出的热量 ( )
| A.大于57.3 kJ | B.等于57.3 kJ |
| C.小于57.3 kJ | D.无法确定 |
反应:2H2(g)+O2(g)===2H2O(l)过程中的能量变化如图所示,下列有关说法中正确的是( )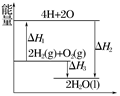
| A.ΔH1<0 | B.ΔH2为该反应的反应热 |
| C.ΔH3不是H2的燃烧热 | D.ΔH2=ΔH1+ΔH3 |
“低碳经济”是以低能耗、低污染、低排放为基础的可持续发展经济模式。下列说法与“低碳经济”不符合的是
| A.大力研发新型有机溶剂替代水作为萃取剂 |
| B.加强对煤、石油、天然气等综合利用的研究,提高燃料的利用率 |
| C.利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 |
| D.甲烷和乙醇的燃烧热分别是891.0 kJ·mol-1、1366.8 kJ·mol-1,利用甲烷更“低碳” |