��Ŀ����
ǿ����ǿ����ϡ��Һ�з����кͷ�Ӧ���Ȼ�ѧ����ʽΪH��(aq)��OH��(aq)=H2O(l)����H����57.3 kJ��mol��1����3��ͬ���0.2 mol ��L��1��NaOH��Һ�зֱ����������ϡ���ᡢŨ���ᡢϡ���ᣬǡ����ȫ��Ӧ����ЧӦ��H1����H2����H3�Ĺ�ϵ��ȷ���� (����)
| A����H1����H2����H3 | B����H2����H3����H1 |
| C����H2����H1����H3 | D����H1����H3����H2 |
D
�������������ϡ�������Ҫ���ȣ�Ũ��������ˮҪ���ȡ�ϡ���ᡢŨ�����ϡ������NaOH��Һ��Ӧ���ɵ���ˮʱŨ���������࣬���������С��
���㣺���⿼�����к��ȵĸ��

 ���źþ���Ԫ����ĩ��ϵ�д�
���źþ���Ԫ����ĩ��ϵ�д����и�������ʾ��ͼһ�µ���
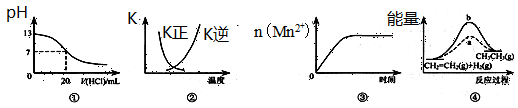
| A��ͼ�ٱ�ʾ25��ʱ����0.1 mol��L��1����ζ�20 mL 0.1 mol��L��1 NaOH��Һ����Һ��pH�����������ı仯 |
B��ͼ�������߱�ʾ��Ӧ2SO2(g) + O2(g)  2SO3(g)����H��0 �����淴Ӧ��ƽ�ⳣ��K���¶ȵı仯 2SO3(g)����H��0 �����淴Ӧ��ƽ�ⳣ��K���¶ȵı仯 |
| C��ͼ�۱�ʾ10 mL 0.01 mol��L��1 KMnO4������Һ�������0.1 mol��L��1 H2C2O4��Һ���ʱ��n(Mn2+) ��ʱ��ı仯 |
| D��ͼ����a��b���߷ֱ��ʾ��ӦCH2��CH2 (g) + H2(g)��CH3CH3(g)����H��0ʹ�ú�δʹ�ô���ʱ����Ӧ�����е������仯 |
��(H2NNH2)��һ�ָ���ȼ�ϣ��йػ�ѧ��Ӧ�������仯����ͼ��ʾ����֪����1 mol��ѧ�����������(kJ)��N��NΪ942��O=OΪ500��N��NΪ154�������1 mol N��H����������(kJ)��(����)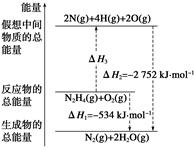
| A��194 | B��391 | C��516 | D��658 |
�����з�Ӧ�����������������ڷ�Ӧ������������
| A������������ˮ | B���Ҵ�ȼ�� | C����������������ĩ��Ӧ | D��̼������ȷֽ� |
��֪298 Kʱ��H��(aq)��OH��(aq)=H2O(l)����H����57.3 kJ��mol��1���Ʋ⺬1 mol HCl��ϡ��Һ�뺬1 mol NH3��ϡ��Һ��Ӧ�ų������� (����)
| A������57.3 kJ | B������57.3 kJ |
| C��С��57.3 kJ | D����ȷ�� |
���������Ȼ�ѧ����ʽ�ó��Ľ�����ȷ���ǣ� ��
A����֪2SO2(g)+O2 2SO3(g)Ϊ���ȷ�Ӧ����SO2������һ������SO3������ 2SO3(g)Ϊ���ȷ�Ӧ����SO2������һ������SO3������ |
| B����֪C(ʯī,s)=C�����ʯ,s����H��0������ʯ��ʯī�ȶ� |
| C����֪H+(aq)+OH-(aq)=H2O��1����H=��57��3kJ��mol�����κ�����к͵ķ�Ӧ�Ⱦ�Ϊ57��3kJ |
| D����֪2C(s)+2O2(g)=2CO2(g)��H1 |
��Ӧ��2H2(g)��O2(g)===2H2O(l)�����е������仯��ͼ��ʾ�������й�˵������ȷ���ǣ� ��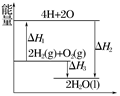
| A����H1��0 | B����H2Ϊ�÷�Ӧ�ķ�Ӧ�� |
| C����H3����H2��ȼ���� | D����H2����H1����H3 |
����˵���д������
| A���ƹ�ʹ������Դ�����Լ��ٶ�����̼������������ŷ� |
| B�����糧��ȼú��ȼ��ʱ��������ʯ��ʯ���ɼ��ٶ��������ŷ� |
| C��ʯ�͡�ú����Ȼ�������ڿ������Ļ�ʯȼ�� |
| D��̫���ܡ����ܡ��������������Դ |
�����Ȼ�ѧ����ʽ�Ц�H��ʾ��ȼ��ȼ���ȵ���
| A��C(s)��1/2O2(g)="CO(g)" ��H=-110.5kJ/mol |
| B��2H2(g)��O2(g)=2H2O(g)��H=-571.6kJ/mol |
| C��CH4(g)��2O2(g)=CO2(g)��2H2O(g) ��H=-890.3kJ/mol |
| D��C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)��H=-2800kJ/mol |