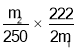题目内容
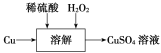
【题目】工业上将Cl2通入KOH热溶液中制取KClO3(混有KClO)。实验室模拟上述制备:向含18mol KOH的溶液中通入Cl2,充分反应后测得溶液中n(Cl-)=12mol,将此溶液低温蒸干,所得到固体中KClO3的物质的量可能为
A.1.5molB.2.1molC.2.4 molD.3.0 mol
【答案】AB
【解析】
根据题意可知,充分反应后,溶液中一定有KCl、KClO、KClO3三种物质,可能有KOH,根据氧化还原反应得失电子守恒可知:Cl2变为Cl-得到的电子数等于Cl2变为KClO、KClO3失去的电子数;由K原子守恒可知:KCl、KClO、KClO3、KOH四种物质的物质的量总和为18mol。
由Cl2~2Cl-~得2e-可知,12molCl-说明Cl2转移了12mol电子;Cl2变为KClO3化合价升高5,Cl2变为KClO化合价升高1,设反应后氯酸钾的物质的量为x mol,次氯酸钾的物质的量为y mol,则共失去电子总物质的量为5x+y,根据得失电子守恒得①式:5x+y=12;根据K原子守恒得②式:x+y+12≤18;另外有③式:y>0。联立①②③得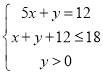 ,解得:
,解得:![]() ,AB满足,CD不满足。答案选AB。
,AB满足,CD不满足。答案选AB。

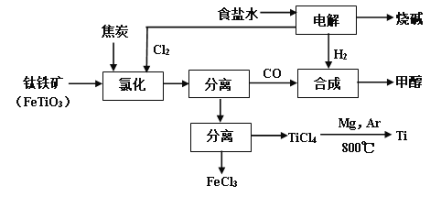
【题目】将炼钛厂、氯碱厂和甲醇厂组成产业链如下,可得到烧碱、甲醇、钛以及其他一些有用的副产品。
已知:合成甲醇的主反应为:CO+2H2![]() CH3OH+Q(Q>0,下同);
CH3OH+Q(Q>0,下同);
同时有副反应如:8CO+17H2![]() C8H18+8H2O+Q;4CO+8H2
C8H18+8H2O+Q;4CO+8H2![]() C4H9OH+3H2O+Q。
C4H9OH+3H2O+Q。
请完成下列填空:
(1)在实验室电解饱和食盐水时,因工业食盐中含有少量氯化钙、硫酸镁等杂质,除杂时先加入沉淀剂,然后过滤,滤渣的成分是__________(填写化学式)。
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式_________。
(3)诸如上述联合生产,其优点有_______。生产中除了获得上述目标产品外,还能得到副产品________(填写化学式)。
(4)在上述产业链中,合成192吨甲醇理论上需额外补充H2 _____吨(不考虑生产过程中物质的损失及副反应)。
(5)上述产业链中“氯化”在6000C以上的反应器内进行。已知:
物质 | 沸点(0C) |
TiCl4 | 136 |
FeCl3 | 315 |
为了将TiCl4从“氯化”后的混合物中分离出来,请设计合理的方案:_______。
【题目】“中和滴定”原理在实际生产生活中应用广泛。用![]() 可定量测定CO的含量,该反应原理为
可定量测定CO的含量,该反应原理为![]() ,其实验步骤如下:
,其实验步骤如下:
①取200 mL(标准状况)含有CO的某气体样品通过盛有足量![]() 的硬质玻璃管中在170℃下充分反应:
的硬质玻璃管中在170℃下充分反应:
②用酒精溶液充分溶解产物![]() ,配制100 mL溶液;
,配制100 mL溶液;
③量取步骤②中溶液20.00 mL于锥形瓶中,然后用![]() 的
的![]() 标准溶液滴定,发生反应为
标准溶液滴定,发生反应为![]() 。消耗标准
。消耗标准![]() 溶液的体积如表所示。
溶液的体积如表所示。
第一次 | 第二次 | 第三次 | |
滴定前读数/mL | 1.10 | 1.50 | 2.40 |
滴定后读数/mL | 21.00 | 21.50 | 22.50 |
(1)步骤②中配制100 mL待测液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和________。
(2)![]() 标准液应装在________(填“酸式”“碱式”)滴定管中。
标准液应装在________(填“酸式”“碱式”)滴定管中。
(3)指示剂应选用________,判断达到滴定终点的现象是________。
(4)气体样品中CO的体积分数为________(已知气体样品中其他成分不与![]() 反应)
反应)
(5)下列操作会造成所测CO的体积分数偏大的是________(填字母)。
a.滴定终点时仰视读数
b.滴定前尖嘴外无气泡,滴定后有气泡
C.配制100 mL待测溶液时,有少量溅出。
d.锥形瓶用待测溶液润洗