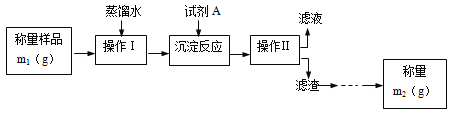
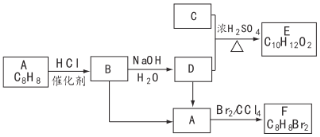
题目内容
【题目】常温下,用0.1000 mol/L盐酸滴定25 mL 0.1000 mol/L Na2CO3溶液,滴定曲线如图。关于滴定过程中所得溶液相关微粒的浓度关系,下列说法正确的是
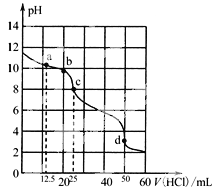
A.a点:c(CO32-)>c(HCO3-)>c(Cl-)
B.b点:5c(Cl-)>4c(HCO3-)+4c(CO32-)
C.c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D.d点:c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
【答案】BD
【解析】
A.a点时碳酸钠与碳酸氢钠物质的量相等,碳酸根离子水解程度大,碳酸氢根离子浓度大于碳酸根离子,A错误;
B.b点时碳酸钠还没有完全转化为碳酸氢钠,根据物料守恒可得:5c(Cl-)=4c(HCO3-)+4c(CO32-)+4c(H2CO3),B正确;
C.c点为氯化钠与碳酸氢钠的混合液,根据质子守恒可得:c(OH-)+ c(CO32-)=c(H+)+ c(H2CO3),若c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),成立,则有c(HCO3-)+c(H2CO3)+c(CO32-)=0,很显然,不可能,C错误;
D.d点为氯化钠和二氧化碳的饱和溶液,根据电荷守恒,c(H+)+c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-),而c(Na+)=c(Cl-),故c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),D正确。
答案选BD。

练习册系列答案
相关题目