题目内容
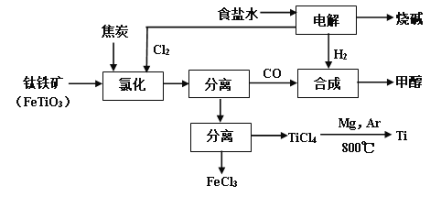
【题目】将炼钛厂、氯碱厂和甲醇厂组成产业链如下,可得到烧碱、甲醇、钛以及其他一些有用的副产品。
已知:合成甲醇的主反应为:CO+2H2![]() CH3OH+Q(Q>0,下同);
CH3OH+Q(Q>0,下同);
同时有副反应如:8CO+17H2![]() C8H18+8H2O+Q;4CO+8H2
C8H18+8H2O+Q;4CO+8H2![]() C4H9OH+3H2O+Q。
C4H9OH+3H2O+Q。
请完成下列填空:
(1)在实验室电解饱和食盐水时,因工业食盐中含有少量氯化钙、硫酸镁等杂质,除杂时先加入沉淀剂,然后过滤,滤渣的成分是__________(填写化学式)。
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式_________。
(3)诸如上述联合生产,其优点有_______。生产中除了获得上述目标产品外,还能得到副产品________(填写化学式)。
(4)在上述产业链中,合成192吨甲醇理论上需额外补充H2 _____吨(不考虑生产过程中物质的损失及副反应)。
(5)上述产业链中“氯化”在6000C以上的反应器内进行。已知:
物质 | 沸点(0C) |
TiCl4 | 136 |
FeCl3 | 315 |
为了将TiCl4从“氯化”后的混合物中分离出来,请设计合理的方案:_______。
【答案】BaSO4、CaCO3、BaCO3、Mg(OH)2 2FeTiO3+ 6C+ 7Cl2 → 2FeCl3+2TiCl4+6CO 大大提高资源利用率;降低生产成本;减少环境污染等 C8H8、C4H9OH、FeCl3、MgCl2 10 将氯化后的混合物冷却至1360C以下,使TiCl4和FeCl3均为液体;加热蒸馏混合液体,收集1360C的馏分
【解析】
(1)加入氢氧化钠除去镁离子,生成氢氧化镁,再加入氯化钡除去硫酸根离子,生成硫酸钡沉淀,然后加入碳酸钠除去钡离子和钙离子,生成碳酸钡和碳酸钙,故答案为:![]() 、
、![]() 、
、![]() 、
、![]() ;
;
(2)从图示可知氯化时的反应物为![]() 、C、
、C、![]() ,生成物为
,生成物为![]() 、
、![]() 、CO,再根据得失电子和原子守恒即可得出该反应的方程式为2FeTiO3+ 6C+ 7Cl2 → 2FeCl3+2TiCl4+6CO;
、CO,再根据得失电子和原子守恒即可得出该反应的方程式为2FeTiO3+ 6C+ 7Cl2 → 2FeCl3+2TiCl4+6CO;
(3)氯碱工业中的产物高效利用,大大提高资源利用率,降低生产成本,有毒气体一氧化碳的利用,减少了环境污染,合成甲醇的主反应为:![]() ;同时有副反应如:
;同时有副反应如:![]() ;
;![]() ,所以还能得到副产品是
,所以还能得到副产品是![]() 、
、![]() 、
、![]() 、
、![]() ,故答案为:大大提高资源利用率;降低生产成本;减少环境污染等;
,故答案为:大大提高资源利用率;降低生产成本;减少环境污染等;![]() 、
、![]() 、
、![]() 、
、![]() ;
;
(4)根据![]() ,
,![]() ,所以生产1
,所以生产1![]() ,理论上还需补充氢气
,理论上还需补充氢气![]() ,即
,即![]() ,故生产192t
,故生产192t![]() 还需补充
还需补充![]() 的质量10t,故答案为:10;
的质量10t,故答案为:10;
(5)由于两种氯化物有沸点不同,应用蒸馏的方法分离,具体操作将氯化后的混合物冷却至![]() 以下,使
以下,使![]() 和
和![]() 均为液体;加热蒸馏混合液体,收集
均为液体;加热蒸馏混合液体,收集![]() 的馏分,故答案为:将氯化后的混合物冷却至
的馏分,故答案为:将氯化后的混合物冷却至![]() 以下,使
以下,使![]() 和
和![]() 均为液体;加热蒸馏混合液体,收集
均为液体;加热蒸馏混合液体,收集![]() 的馏分。
的馏分。

 第1卷单元月考期中期末系列答案
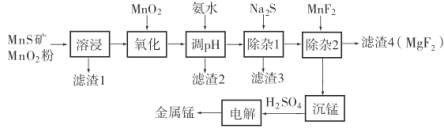
第1卷单元月考期中期末系列答案【题目】锰不仅在工业上用途广泛,还是人体内必需的微量元素,对人体健康起着重要的作用。一种以天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)为原料制备金属锰的流程如图所示。请回答下列问题:
相关金属离子![]() 形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:
金属离子 |
|
|
|
|
|
|
|
开始沉淀pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“溶浸”中需加入的试剂是________(填化学式)。
(2)“调pH”除铁和铝,溶液的pH范围应调节为________~6之间。
(3)“滤渣2”的主要成分是________________________________(填化学式)。
(4)![]() 可做“沉锰”试剂,该物质的水溶液呈碱性,其溶液中离子浓度由大到小的顺序为________________________________。
可做“沉锰”试剂,该物质的水溶液呈碱性,其溶液中离子浓度由大到小的顺序为________________________________。
(5)“沉锰”得到![]() 沉淀,写出该反应的离子方程式________________。
沉淀,写出该反应的离子方程式________________。
(6)电解硫酸锰溶液制备单质锰时,阴极的电极反应为________;电解后的电解质溶液可返回________工序继续使用。