题目内容
【题目】氯化铜可用于生产颜料、木材防腐剂等.用粗铜(含杂质Fe)经过系列步骤可制备氯化铜晶体(CuCl22H2O).完成下列填空:
(1)实验室用浓盐酸和二氧化锰共热来制备Cl2,写出该反应的离子方程式______.
(2)加入试剂将CuCl2和FeCl3的混合溶液pH调至4~5,过滤得到纯净的CuCl2溶液,应加入的试剂是__ (填字母编号)
a CuO b NaOH c Cu2(OH)2CO3 d Cu
(3)CuCl2溶液通过蒸发、结晶可得到CuCl22H2O.
①蒸发过程中,加入盐酸的目的是____.
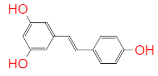
②蒸发过程中,观察到溶液颜色由蓝色变为绿色.
其原理是:![]()

上述反应的化学平衡常数表达式是______.欲使溶液由绿色变成蓝色的措施是:a______;b______.
(4)由CuSO4溶液蒸发结晶得到CuSO45H2O的过程中不用加入硫酸,其原因是______(用勒夏特列原理解释).
【答案】MnO2+4H++2Cl﹣![]() Mn2++Cl2↑+2H2O ac 抑制铜离子的水解,提高产品的产率
Mn2++Cl2↑+2H2O ac 抑制铜离子的水解,提高产品的产率 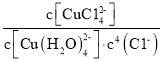 加水稀释 AgNO3溶液 Cu2+易发生水解,加热促进水解;但硫酸不挥发,且浓度越来越大,从而抑制水解;水不断蒸发,最终得到晶体
加水稀释 AgNO3溶液 Cu2+易发生水解,加热促进水解;但硫酸不挥发,且浓度越来越大,从而抑制水解;水不断蒸发,最终得到晶体
【解析】
(1)在加热条件下浓盐酸与二氧化锰反应生成氯气、氯化锰和水;
(2)调节pH时不能消耗铜离子,也不能引入新的杂质;
(3)①铜离子水解显酸性,加酸抑制水解;
②根据反应方程式书写,水不能写入平衡常数表达式;溶液由绿色变成蓝色,则平衡逆向移动,根据影响化学平衡移动的因素分析;
(4)CuSO4在溶液中水解生成难挥发性酸,水解不能完全进行。
(1)在加热条件下浓盐酸与二氧化锰反应生成氯气、氯化锰和水,其反应的离子方程式为:MnO2+4H++2Cl﹣![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)调节pH时不能消耗铜离子,也不能引入新的杂质,加NaOH会引入钠离子,Cu与氢离子不反应,所以可以选用CuO和Cu2(OH)2CO3,故答案为:ac;
(3)①铜离子水解显酸性,加酸抑制水解,所以蒸发过程中,要加入盐酸来抑制氯化铜的水解,从而提高产率;
②蒸发过程中,观察到溶液颜色由蓝色变为绿色,其原理是:![]() ,则反应的平衡常数为K=
,则反应的平衡常数为K=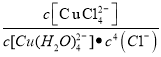 ;溶液由绿色变成蓝色,则平衡逆向移动,加水稀释,平衡逆向移动,加AgNO3溶液会消耗氯离子,反应物的浓度减小,平衡逆向移动;
;溶液由绿色变成蓝色,则平衡逆向移动,加水稀释,平衡逆向移动,加AgNO3溶液会消耗氯离子,反应物的浓度减小,平衡逆向移动;
(4)CuSO4在溶液中水解生成难挥发性酸硫酸,加热促进水解,但水解生成的硫酸不挥发,随着水的减少,硫酸的浓度越来越大,从而抑制了硫酸铜的水解,最终得到晶体。