题目内容
【题目】“中和滴定”原理在实际生产生活中应用广泛。用![]() 可定量测定CO的含量,该反应原理为
可定量测定CO的含量,该反应原理为![]() ,其实验步骤如下:
,其实验步骤如下:
①取200 mL(标准状况)含有CO的某气体样品通过盛有足量![]() 的硬质玻璃管中在170℃下充分反应:
的硬质玻璃管中在170℃下充分反应:
②用酒精溶液充分溶解产物![]() ,配制100 mL溶液;
,配制100 mL溶液;
③量取步骤②中溶液20.00 mL于锥形瓶中,然后用![]() 的
的![]() 标准溶液滴定,发生反应为
标准溶液滴定,发生反应为![]() 。消耗标准
。消耗标准![]() 溶液的体积如表所示。
溶液的体积如表所示。
第一次 | 第二次 | 第三次 | |
滴定前读数/mL | 1.10 | 1.50 | 2.40 |
滴定后读数/mL | 21.00 | 21.50 | 22.50 |
(1)步骤②中配制100 mL待测液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和________。
(2)![]() 标准液应装在________(填“酸式”“碱式”)滴定管中。
标准液应装在________(填“酸式”“碱式”)滴定管中。
(3)指示剂应选用________,判断达到滴定终点的现象是________。
(4)气体样品中CO的体积分数为________(已知气体样品中其他成分不与![]() 反应)
反应)
(5)下列操作会造成所测CO的体积分数偏大的是________(填字母)。
a.滴定终点时仰视读数
b.滴定前尖嘴外无气泡,滴定后有气泡
C.配制100 mL待测溶液时,有少量溅出。
d.锥形瓶用待测溶液润洗
【答案】100 mL容量瓶 碱式 淀粉溶液 当滴加最后一滴标准液,溶液由蓝色变为无色且半分钟内不恢复原色 28% ad
【解析】
(1)分析配制100 mL待测液需要用到的玻璃仪器。
(2)![]() 溶液显碱性。
溶液显碱性。
(3)淀粉遇见单质碘变蓝。
(4)计算消耗标准![]() 溶液的体积,再根据方程式得到关系式进行计算。
溶液的体积,再根据方程式得到关系式进行计算。
(5)a. 滴定终点时仰视读数,硫代硫酸钠读数偏大;b. 滴定前尖嘴外无气泡,滴定后有气泡,硫代硫酸钠读数偏小;c. 配制100 mL待测溶液时,有少量溅出,消耗硫代硫酸钠偏少;d. 锥形瓶用待测溶液润洗,消耗硫代硫酸钠偏大。
(1)步骤②中配制100 mL待测液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和100 mL容量瓶;故答案为:100 mL容量瓶。
(2)![]() 溶液显碱性,因此标准液应装在碱式滴定管中;故答案为:碱式。
溶液显碱性,因此标准液应装在碱式滴定管中;故答案为:碱式。
(3)淀粉遇见单质碘变蓝,因此指示剂应选用淀粉溶液,判断达到滴定终点的现象是当滴加最后一滴标准液,溶液由蓝色变为无色且半分钟内不恢复原色;故答案为:淀粉溶液;当滴加最后一滴标准液,溶液由蓝色变为无色且半分钟内不恢复原色。
(4)消耗标准![]() 溶液的体积为20.00mL,根据方程式得到关系式为
溶液的体积为20.00mL,根据方程式得到关系式为
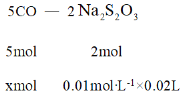
5mol:xmol = 2mol :0.01molL-1×0.02L
解得x = 0.0005mol,得到气体样品中CO的体积分数为![]() ;故答案为:28%。
;故答案为:28%。
(5)a. 滴定终点时仰视读数,硫代硫酸钠读数偏大,测得结果偏大,故a符合题意;b. 滴定前尖嘴外无气泡,滴定后有气泡,硫代硫酸钠读数偏小,测得结果偏小,故b不符合题意;c. 配制100 mL待测溶液时,有少量溅出,消耗硫代硫酸钠偏少,测定结果偏低,故c不符合题意;d. 锥形瓶用待测溶液润洗,消耗硫代硫酸钠偏大,测定结果偏高,故d符合题意;综上所述,答案为:ad。

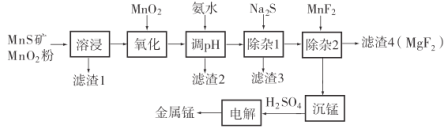
【题目】锰不仅在工业上用途广泛,还是人体内必需的微量元素,对人体健康起着重要的作用。一种以天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)为原料制备金属锰的流程如图所示。请回答下列问题:
相关金属离子![]() 形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:
金属离子 |
|
|
|
|
|
|
|
开始沉淀pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“溶浸”中需加入的试剂是________(填化学式)。
(2)“调pH”除铁和铝,溶液的pH范围应调节为________~6之间。
(3)“滤渣2”的主要成分是________________________________(填化学式)。
(4)![]() 可做“沉锰”试剂,该物质的水溶液呈碱性,其溶液中离子浓度由大到小的顺序为________________________________。
可做“沉锰”试剂,该物质的水溶液呈碱性,其溶液中离子浓度由大到小的顺序为________________________________。
(5)“沉锰”得到![]() 沉淀,写出该反应的离子方程式________________。
沉淀,写出该反应的离子方程式________________。
(6)电解硫酸锰溶液制备单质锰时,阴极的电极反应为________;电解后的电解质溶液可返回________工序继续使用。