题目内容
20.两个体积相同的容器,一只盛有HCl气体,另一个盛有H2和Cl2的混合气体,同温同压下两容器内的气体一定具有相同的( )| A. | 质子总数 | B. | 原子总数 | C. | 分子总数 | D. | 质量 |
分析 在同温同压下,相同体积的任何气体含有相同的分子数,HCl、H2和Cl2都是双原子分子,当分子数相等时,原子数一定相等;H2和Cl2的物质的量之比为1:1时相当于HCl,两个容器内的密度、质量和质子数相等,但H2和Cl2的物质的量之比不一定为1:1,质子总数不一定相等,质量也不一定相等.
解答 解:同温同压下,氢气、氯气的总体积与HCl体积相等,则H2和Cl2总物质的量与HCl物质的量相等.
A.H2和Cl2的物质的量之比为1:1时,两容器内含有质子总数相等,但H2和Cl2的物质的量之比不一定为1:1,故两容器内质子数不一定相等,故A错误;
B.H2和Cl2总物质的量与HCl物质的量相等,都是双原子分子,当二者分子数相等时,原子数一定相等,故B正确;
C.在同温同压下,相同体积的任何气体含有相同的分子数,故C正确;
D.氢气与氯气的物质的量之比为1:1时,氢气、氯气的总质量与HCl的质量相等,但氢气、氯气的物质的量之比不一定为1:1,故氢气、氯气的总质量与HCl的质量不一定相等,故D错误,
故选:BC.
点评 本题考查阿伏加德罗定律的应用,注意相关计算公式的运用,注意氢气与氯气物质的量相等时可以相当于为HCl.

练习册系列答案
相关题目
10.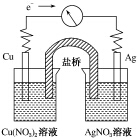 将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是( )
将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是( )
 将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是( )
将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是( )| A. | KNO3盐桥中的K+移向Cu(NO3)2溶液 | |
| B. | Cu作负极,发生还原反应 | |
| C. | 电子由AgNO3溶液通过盐桥移向Cu(NO3)2溶液 | |
| D. | 工作一段时间后,AgNO3溶液中c(Ag+)减小 |
11.图表示298K时N2与H2反应过程中的能量变化.根据右图叙述正确的是( )
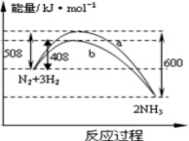

| A. | 该反应的热化学方程式为: $\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g),△H=-92kJ•mol-1 | |
| B. | 不用催化剂,生成 1molNH3放出的热量为46 KJ | |
| C. | 加入催化剂,生成 1molNH3的反应热减小50 KJ•mol-1 | |
| D. | 在温度体积一定的条件下,通入1molN2和3molH2,反应后放出的热量为Q1,若通入2molN2和6molH2,反应后放出的热量为Q2,则Q1=0.5Q2<92KJ |
8.设NA为阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 18g重水(D2O)中含有10NA个电子 | |
| B. | 22.4L一氯甲烷的分子数约为NA | |
| C. | 4.6g Na在氧气中完全反应生成Na2O和Na2O2,转移电子数为0.2NA | |
| D. | 25℃时,1L pH=14的Ba(OH)2溶液中,Ba2+数目为NA |
15.某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
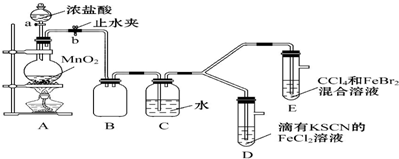
(1)检查气体发生装置A的气密性的操作是关闭止水夹b,打开活塞a,向分液漏斗中注水,若水不能顺利流下,则气密性良好.
(2)实验过程如下:
(3)因忙于观察和记录,没有及时停止反应,D装置中又有新的变化:红色慢慢褪去.
①为了探究溶液“红色慢慢褪去”的原因,进行如下实验.
取D中溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.取D中溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.实验证明“红色慢慢褪去”的原因是过量氯气和SCN-反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,则使Fe3++3SCN-?Fe(SCN)3平衡向逆反应方向移动而褪色.
②猜测SCN-可能被Cl2氧化了,又进行了如下研究.
资料显示:
SCN-的电子式为 ,认为SCN-中碳元素没有被氧化,理由是SCN-中碳元素是最高价态+4价.取D中溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是硫元素.通过实验证明了SCN-中氮元素转化为NO3-,若SCN-与Cl2反应生成1mol CO2,则转移电子的物质的量是16mol.
,认为SCN-中碳元素没有被氧化,理由是SCN-中碳元素是最高价态+4价.取D中溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是硫元素.通过实验证明了SCN-中氮元素转化为NO3-,若SCN-与Cl2反应生成1mol CO2,则转移电子的物质的量是16mol.
(4)整套实验装置存在一处明显不足,请在下面的方框内画出相应的改进装置.


(1)检查气体发生装置A的气密性的操作是关闭止水夹b,打开活塞a,向分液漏斗中注水,若水不能顺利流下,则气密性良好.
(2)实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯 | D装置中:溶液变红色;E装置中:水层溶液变黄色,振荡后CCl4层无明显变化 | Cl2、Br2、Fe3+氧化性由强到弱的顺序为Cl2>Br2>Fe3+ |
①为了探究溶液“红色慢慢褪去”的原因,进行如下实验.
取D中溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.取D中溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.实验证明“红色慢慢褪去”的原因是过量氯气和SCN-反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,则使Fe3++3SCN-?Fe(SCN)3平衡向逆反应方向移动而褪色.
②猜测SCN-可能被Cl2氧化了,又进行了如下研究.
资料显示:
SCN-的电子式为
 ,认为SCN-中碳元素没有被氧化,理由是SCN-中碳元素是最高价态+4价.取D中溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是硫元素.通过实验证明了SCN-中氮元素转化为NO3-,若SCN-与Cl2反应生成1mol CO2,则转移电子的物质的量是16mol.
,认为SCN-中碳元素没有被氧化,理由是SCN-中碳元素是最高价态+4价.取D中溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是硫元素.通过实验证明了SCN-中氮元素转化为NO3-,若SCN-与Cl2反应生成1mol CO2,则转移电子的物质的量是16mol.(4)整套实验装置存在一处明显不足,请在下面的方框内画出相应的改进装置.

5.下列说法正确的是( )
| A. | 把SO2通入酸性高锰酸钾溶液,即可验证SO2的漂白性 | |
| B. | 无论是在0.1mol•L-1的CH3COOH溶液中加水稀释,还是加入少量CH3COONa晶体,都会引起溶液的导电能力减弱 | |
| C. | 实验室需用480mL 0.1mol•L-1硫酸铜溶液,应称取12.5g胆矾晶体,并用500mL容量瓶定容配制 | |
| D. | 硫酸亚铁铵晶体中NH4+的检验操作为:取适量样品置于试管中加水溶解,滴加少量稀氢氧化钠溶液,并将湿润的红色石蕊试纸靠近试管口,试纸变蓝则存在NH4+,反之则不存在NH4+ |
12.己知:2Fe+3Br2=2FeBr3,Fe2+的还原性大于Br-.现有16.8g铁和0.3mol Br2反应后加入水得到澄清溶液后,通入a mol Cl2.下列叙述不正确的是( )
| A. | 当a=0.1时,发生的反应为2Fe2++Cl2-2Fe3++2C1- | |
| B. | 当a=0.45时,发生的反应为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- | |
| C. | 若溶液中Br-有一半被氧化时,c (Fe3+):c(Br-):c (Cl-)-1:1:3 | |
| D. | 当0<a<0.15时,溶液中始终满足2c(Fe2+)+3c (Fe3+)+c(H)=c(C1-)+c(Br-)+c(OH-) |
9.120mL含有2mol碳酸钠的溶液和200mL,1.5mol•L-1盐酸,不管将前者滴加入后者,还是将后者滴加入前者,下列叙述正确的是( )
| A. | Na2CO3溶液中加盐酸,无气体生成 | |
| B. | 盐酸中加入Na2CO3溶液,开始无气体,后有气体生成 | |
| C. | 无论怎么滴加,都有气体生成,且生成的气体一样多 | |
| D. | 无论怎么滴加,都有气体生成,且盐酸中滴加Na2CO3溶液产生的气体多 |
