题目内容
16. 某可逆反应的平衡常数表达式为K=$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$,恒容时,温度升高H2浓度减小.试回答下列问题:
某可逆反应的平衡常数表达式为K=$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$,恒容时,温度升高H2浓度减小.试回答下列问题:(1)该反应的化学方程式为CO2(g)+H2(g)?CO(g)+H2O(g).
(2)温度升高,该反应的K值增大(填“增大”“减小”或“不变”),化学平衡移动达到新的平衡后,CO2和CO体积比减小(填“增大”“减小”或“不变”).
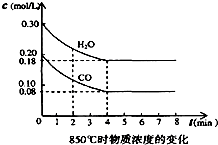
(3)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生反应,CO和H2O浓度变化如下图.则 0-4min的平均反应速率v(CO)=0.03 mol•L-1•min-1,850℃的化学平衡常数的值K=1.
(4)850℃时,在相同容器中发生反应CO2 (g)+H2 (g)═CO (g)+H2O (g),t时刻容器内各物质的浓度分别为:一氧化碳0.09mol•L-1、水蒸气0.09mol•L-1、二氧化碳0.08mol•L-1、氢气 0.08mol•L-1,此时v(正)小于v(逆)(“大于”“小于”或“等于”)
分析 (1)平衡常数是指:一定温度下,可逆反应到达平衡时,生成物浓度系数次幂乘积与反应物浓度系数次幂乘积的比,故反应方程式为:CO2(g)+H2(g)?CO(g)+H2O(g);
(2)恒容时,温度升高H2浓度减小,说明升高温度平衡正向移动,平衡常数增大,到达新平衡CO物质的量增大、二氧化碳物质的量减小;
(3)由图可知,4min到达平衡时,CO的浓度为0.08mol/L,则:
CO2(g)+H2(g)?CO(g)+H2O(g)
起始量(mol/L):0 0 0.2 0.3
转化量(mol/L):0.12 0.12 0.12 0.12
平衡量(mol/L):0.12 0.12 0.08 0.18
根据v=$\frac{△c}{△t}$计算v(CO),平衡常数K=$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$;
(4)计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行,进而判断v(正)、v(逆)相对大小.
解答 解:(1)平衡常数是指:一定温度下,可逆反应到达平衡时,生成物浓度系数次幂乘积与反应物浓度系数次幂乘积的比,平衡常数表达式为K=$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$,故反应方程式为:CO2(g)+H2(g)?CO(g)+H2O(g),
故答案为:CO2(g)+H2(g)?CO(g)+H2O(g);
(2)恒容时,温度升高H2浓度减小,说明升高温度平衡正向移动,平衡常数K增大,到达新平衡CO物质的量增大、二氧化碳物质的量减小,则CO2和CO体积比减小,
故答案为:增大;减小;
(3)由图可知,4min到达平衡时,CO的浓度为0.08mol/L,则:
CO2(g)+H2(g)?CO(g)+H2O(g)
起始量(mol/L):0 0 0.2 0.3
转化量(mol/L):0.12 0.12 0.12 0.12
平衡量(mol/L):0.12 0.12 0.08 0.18
故v(CO)=$\frac{0.12mol/L}{4min}$=0.03mol•L-1•min-1,平衡常数K=$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$=$\frac{0.08×0.18}{0.12×0.12}$=1,
故答案为:0.03;1;
(4)此时浓度商Qc=$\frac{0.09×0.09}{0.08×0.08}$=1.27>K=1,反应向逆反应进行,故v(正)<v(逆),
故答案为:小于.
点评 本题考查化学平衡计算、反应速率计算、平衡常数计算与应用,注意三段式解题法在化学平衡计算中应用,理解平衡常数应用.

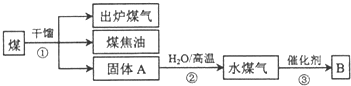
| A. | 煤和水煤气均是二次能源 | |
| B. | 煤中含有苯、甲苯、二甲苯等有机物 | |
| C. | ①是将煤在空气中加强热使其分解的过程 | |
| D. | B为甲醇或乙酸时,原子利用率均达到100% |
| A. | 二氧化碳气体通入无色酚酞溶液,溶液变红色 | |
| B. | 细铁丝在氧气里剧烈燃烧,火星四射 | |
| C. | 点燃棉线闻到一股烧焦的羽毛味 | |
| D. | 打开浓盐酸试剂瓶的瓶塞,瓶口上方出现大量白烟 |
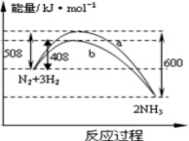
| A. | 该反应的热化学方程式为: $\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g),△H=-92kJ•mol-1 | |
| B. | 不用催化剂,生成 1molNH3放出的热量为46 KJ | |
| C. | 加入催化剂,生成 1molNH3的反应热减小50 KJ•mol-1 | |
| D. | 在温度体积一定的条件下,通入1molN2和3molH2,反应后放出的热量为Q1,若通入2molN2和6molH2,反应后放出的热量为Q2,则Q1=0.5Q2<92KJ |
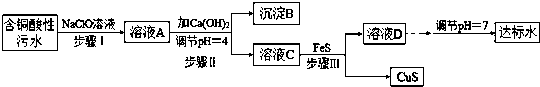
相关信息:
①含铜酸性污水主要污染物离子(见表-1)
表-1
| 离子 | H+ | Cu2+ | Fe3+ | Fe2+ |
| 浓度/(mol/L) | 0.1 | 0.05 | 0.04 | 0.002 |
③FeS能溶于pH<4的酸性溶液.
④25℃时,某些难溶电解质的溶度积(Ksp) (见表-2)
表-2
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | FeS | CuS |
| Kw | 4.0×10-38 | 8.0×10-16 | 2.2×10-20 | 6.4×10-13 | 6.0×10-36 |
(1)该含铜酸性污水的pH=1.
(2)步骤Ⅰ中所发生的主要反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(3)步骤II中,调节溶液的pH=4的目的为使沉淀完全,防止沉淀,防止FeS溶解.
(4)有人认为,步骤II中只需加入Ca(OH)2调节溶液的pH=7,即可将污水处理成符合标准的达标水,该观点不合理(填“合理”或“不合理”),试通过简单计算说明理由pH=7时溶液中c(Cu2+)=2.2×10-20÷(10-7)2=2.2×10-6mol•L-1,大于国家规定的排放标准c(Cu2+)≤1.0×10-7mol•L-1.
(5)步骤III中所发生的主要反应的离子方程式为Cu2++FeS=CuS+Fe2+;该过程不选用易溶的Na2S作沉淀剂,其原因可能为Na2S价格高且引入过多杂质离子.
(6)上述整个处理工艺中,可以回收的金属化合物有Fe(OH)3、CuS(填化学式).
| A. | 18g重水(D2O)中含有10NA个电子 | |
| B. | 22.4L一氯甲烷的分子数约为NA | |
| C. | 4.6g Na在氧气中完全反应生成Na2O和Na2O2,转移电子数为0.2NA | |
| D. | 25℃时,1L pH=14的Ba(OH)2溶液中,Ba2+数目为NA |
| A. | 把SO2通入酸性高锰酸钾溶液,即可验证SO2的漂白性 | |
| B. | 无论是在0.1mol•L-1的CH3COOH溶液中加水稀释,还是加入少量CH3COONa晶体,都会引起溶液的导电能力减弱 | |
| C. | 实验室需用480mL 0.1mol•L-1硫酸铜溶液,应称取12.5g胆矾晶体,并用500mL容量瓶定容配制 | |
| D. | 硫酸亚铁铵晶体中NH4+的检验操作为:取适量样品置于试管中加水溶解,滴加少量稀氢氧化钠溶液,并将湿润的红色石蕊试纸靠近试管口,试纸变蓝则存在NH4+,反之则不存在NH4+ |
 A、B、C、D、E五种元素位于周期表的前四周期,原子序数依次增大.A元素可以形成-1价离子,B、D最外层电子数都是电子层数的2倍,C原子基态时2p轨道内未成对电子数最多,E原子位于周期表ds区,且d轨道中的电子数与最外层电子数之比为5:1.
A、B、C、D、E五种元素位于周期表的前四周期,原子序数依次增大.A元素可以形成-1价离子,B、D最外层电子数都是电子层数的2倍,C原子基态时2p轨道内未成对电子数最多,E原子位于周期表ds区,且d轨道中的电子数与最外层电子数之比为5:1. ;
;