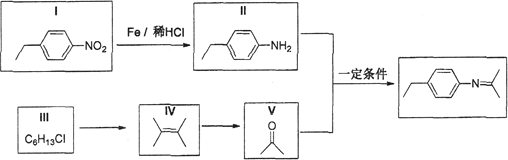
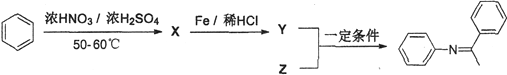
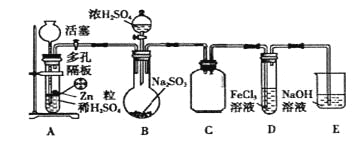
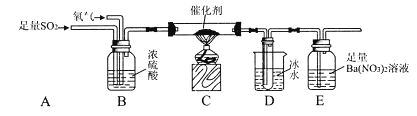
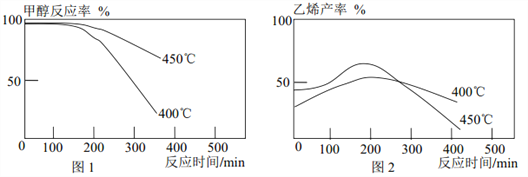
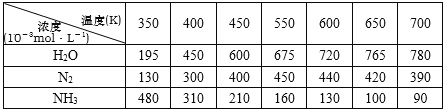
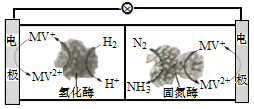
题目内容
【题目】某学生用0.1000mol·L-1标准NaOH溶液滴定未知浓度的盐酸,其操作为以下几步:
A.用标准NaOH溶液润洗碱式滴定管2~3次
B.取标准NaOH溶液注入碱式滴定管到“0”刻度以上2~3cm
C.把盛有标准NaOH溶液的碱式滴定管固定好,挤压玻璃珠,使滴定管尖嘴充满溶液
D.调节液面至“0”或“0”刻度以下,记下读数
E.移取25.00mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞溶液
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定到终点,并记下滴定管液面的读数
(1)下图中属于碱式滴定管的_____(选填:“甲”、“乙”)。

(2)判断到达滴定终点的实验现象是_____。
(3)上述E步操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响是_____(填“偏大”或“偏小”或“无影响”)。
(4)若平行实验三次,记录的数据如下表
滴定次数 | 待测溶液的体积(/mL) | 标准NaOH溶液的体积 | |
滴定前读数(/mL) | 滴定后读数(/mL) | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
试计算待测盐酸的物质的量浓度(写出计算过程)________。
【答案】乙 溶液由无色变为浅红色,且半分钟内不褪色 偏大 0.0800 mol·L-1
【解析】
(1) 酸式滴定管下端为玻璃活塞,碱式滴定管下端用橡皮管连接一支带有尖嘴的小玻璃管;
(2)如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(3)根据![]() ,判断不当操作对相关物理量的影响;
,判断不当操作对相关物理量的影响;
(4)根据关系式HCl~NaOH,来计算出盐酸的浓度。
(1)滴定管下端是橡皮管的为碱式滴定管,故答案为:乙;
(2)本实验是用NaOH滴定盐酸溶液,用酚酞作指示剂,所以终点时的现象为当溶液由无色变为浅红色,且在半分钟内不褪色,故答案为:溶液由无色变为浅红色,且半分钟内不褪色;
(3)锥形瓶用蒸馏水洗涤后,如果再用待测液润洗,会使锥形瓶内溶质的物质的量增大,会造成V(标准)偏大,根据![]() 分析可知,会造成c(待测)偏大,故答案为:偏大;
分析可知,会造成c(待测)偏大,故答案为:偏大;
(4)消耗NaOH溶液的体积为![]() ,则n(HCl)=n(NaOH), c(HCl)×25.00mL=0.1000molL-1×20.00mL;
,则n(HCl)=n(NaOH), c(HCl)×25.00mL=0.1000molL-1×20.00mL;
c(HCl)=0.0800molL-1,故答案为:0.0800 mol·L-1。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】四氯化锡![]() 是一种重要的化工产品。某兴趣小组拟制备四氯化锡。
是一种重要的化工产品。某兴趣小组拟制备四氯化锡。
I.(查阅资料)
物质 | 熔点 | 沸点 | 化学性质 |
Sn | 231 | 227 | 加热时与 |
| 246 | 652 |
|
|
| 114 | 极易水解 |
Ⅱ![]() (制备产品)
(制备产品)
实验装置如图所示![]() 省略夹持和加热装置
省略夹持和加热装置![]()
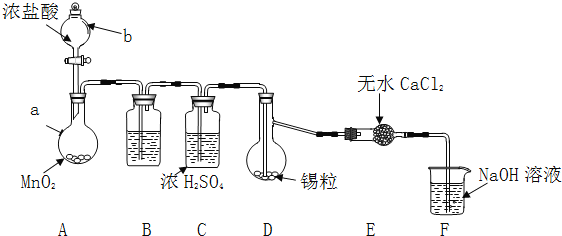
实验步骤:
(1)检查装置气密性后,按图示加入试剂.仪器b的名称是 ______ ,其中无水![]() 的作用是 ______ ,B中的试剂是 ______
的作用是 ______ ,B中的试剂是 ______ ![]() 选填下列字母编号
选填下列字母编号![]() 。
。
A.![]() 溶液
溶液 ![]() 溶液
溶液
![]() 饱和NaCl溶液
饱和NaCl溶液 ![]() 溶液
溶液
(2)先向A中烧瓶内加入盐酸并加热a,当整个装置 ______ 后![]() 填实验现象
填实验现象![]() ,再加热熔化锡粒,反应完后,停止加热。
,再加热熔化锡粒,反应完后,停止加热。
(3)待反应结束后,经 ______ ![]() 填写操作名称
填写操作名称![]() 、洗涤、干燥,可回收利用装置A中未反应完的
、洗涤、干燥,可回收利用装置A中未反应完的![]() 。
。
Ⅲ![]() 探究与反思
探究与反思![]()
(1)装置F中吸收![]() 发生反应的离子方程式是 ______ 。
发生反应的离子方程式是 ______ 。
(2)实验在D中得到的产品很少,经分析装置设计有缺陷,应在D和E之间补充 ______ ![]() 填装置名称
填装置名称![]() 。
。
(3)为验证产品中是否含有![]() ,该小组设计了以下实验方案:
,该小组设计了以下实验方案:![]() 所需试剂从稀
所需试剂从稀![]() 、稀HCl、
、稀HCl、![]() 溶液、
溶液、![]() 溶液、KSCN溶液、蒸馏水中选择
溶液、KSCN溶液、蒸馏水中选择![]()
取适量![]() 产品溶入20mL蒸馏水中,加入 ______ ,若 ______
产品溶入20mL蒸馏水中,加入 ______ ,若 ______ ![]() 填实验现象
填实验现象![]() ,则含有
,则含有![]() ,否则无
,否则无![]() 。
。