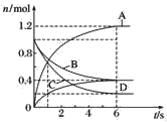
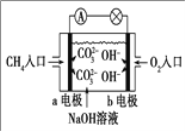
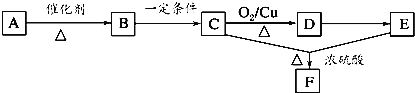
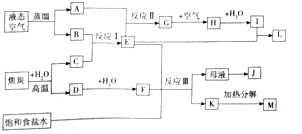
题目内容
【题目】(1)写出下列物质在水溶液中电离的方程式:
HNO3__;
HClO__;
NaHCO3__、___。
(2)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___。
【答案】HNO3=H++![]() HClO
HClO![]() H++ClO- NaHCO3=Na++
H++ClO- NaHCO3=Na++![]()
![]()
![]() H++
H++![]() 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) H=-1451.52 kJ/mol(或CH3OH(l)+
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) H=-1451.52 kJ/mol(或CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) H=-725.76 kJ/mol)
O2(g)=CO2(g)+2H2O(l) H=-725.76 kJ/mol)
【解析】
用化学式和离子符号表示电离过程的式子称为电离方程式,在电离方程式书写时需要判断该物质为强电解质还是弱电解质,强电解质电离时为完全电离用“=”连接;弱电解质为部分电离用“![]() ”连接;能够表示参加反应物质的量和反应热的关系的化学方程式叫做热化学方程式,书写热化学方程式时需要注明反应物生成物的状态、反应条件和反应热。
”连接;能够表示参加反应物质的量和反应热的关系的化学方程式叫做热化学方程式,书写热化学方程式时需要注明反应物生成物的状态、反应条件和反应热。
(1)HNO3为强电解质,在电离时可以完全电离出氢离子和硝酸根,HNO3的电离方程式为HNO3=H++![]() ;
;
HClO为弱电解质,在电离时可以部分电离出氢离子和次氯酸跟,HClO的电离方程式为HClO![]() H++ClO-;
H++ClO-;
NaHCO3为强电解质,在电离时可以完全电离出钠离子和碳酸氢根,但碳酸氢根为弱电解质,可以继续发生不完全电离,电离出氢离子和碳酸根,NaHCO3的电离方程式为NaHCO3=Na++![]() ,
,![]()
![]() H++
H++![]() ;
;
(2) 甲醇燃烧的化学方程式为2CH3OH+3O2=2CO2+4H2O,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,则2mol甲醇燃烧生成CO2和液态水时放热2×32×22.68=1451.52kJ,故甲醇燃烧的热化学方程式为2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) H=-1451.52 kJ/mol(或CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) H=-725.76 kJ/mol)。
O2(g)=CO2(g)+2H2O(l) H=-725.76 kJ/mol)。

【题目】 下表为元素周期表中第四周期的部分元素(从左到右按原子序数递增排列),根据要求回答下列问题:
K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
(1)以上元素的基态原子的电子排布中,4s轨道上只有1个电子的元素有______(填元素名称)。
(2)以上元素中,属于s区的元素有_____种,属于d区的元素有______种。
(3)第一电离能I1(Cr)________I1(Co)(填“>”、“<”或“=”,下同)。
(4)现有含钛的两种颜色的晶体,Ti3+的配位数均为6,一种为紫色,一种为绿色,相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的![]() 。试推断紫色晶体的化学式为_________。
。试推断紫色晶体的化学式为_________。
(5)含有元素K的盐的焰色反应为__________色。许多金属盐都可以发生焰色反应,其原因是____________。
【题目】某学生用0.1000mol·L-1标准NaOH溶液滴定未知浓度的盐酸,其操作为以下几步:
A.用标准NaOH溶液润洗碱式滴定管2~3次
B.取标准NaOH溶液注入碱式滴定管到“0”刻度以上2~3cm
C.把盛有标准NaOH溶液的碱式滴定管固定好,挤压玻璃珠,使滴定管尖嘴充满溶液
D.调节液面至“0”或“0”刻度以下,记下读数
E.移取25.00mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞溶液
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定到终点,并记下滴定管液面的读数
(1)下图中属于碱式滴定管的_____(选填:“甲”、“乙”)。

(2)判断到达滴定终点的实验现象是_____。
(3)上述E步操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响是_____(填“偏大”或“偏小”或“无影响”)。
(4)若平行实验三次,记录的数据如下表
滴定次数 | 待测溶液的体积(/mL) | 标准NaOH溶液的体积 | |
滴定前读数(/mL) | 滴定后读数(/mL) | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
试计算待测盐酸的物质的量浓度(写出计算过程)________。