题目内容
【题目】对氮及其化合物的研究具有重要意义。
(1)对于2NO(g)+O2(g) ![]() 2NO2(g)反应包含以下两个基元反应:
2NO2(g)反应包含以下两个基元反应:
① 2NO(g) ![]() N2O2(g)(快) ΔH1<0 ,υ1正=k1正c2(NO)、υ1逆=k1逆c(N2O2);
N2O2(g)(快) ΔH1<0 ,υ1正=k1正c2(NO)、υ1逆=k1逆c(N2O2);
② N2O2(g)+O2(g) ![]() 2NO2(g)(慢) ΔH2<0,υ2正=k2正c(N2O2)c(O2)、υ2逆=k2逆c2(NO2);决定2NO(g)+O2(g)
2NO2(g)(慢) ΔH2<0,υ2正=k2正c(N2O2)c(O2)、υ2逆=k2逆c2(NO2);决定2NO(g)+O2(g) ![]() 2NO2(g)反应速率快慢的基元反应是________(填标号)。一定条件下,反应2NO(g)+O2(g)
2NO2(g)反应速率快慢的基元反应是________(填标号)。一定条件下,反应2NO(g)+O2(g) ![]() 2NO2(g)达到平衡状态,平衡常数K=_______(用含有k1正、k1逆、k2正、k2逆 的代数式表示)
2NO2(g)达到平衡状态,平衡常数K=_______(用含有k1正、k1逆、k2正、k2逆 的代数式表示)
(2)使用SNCR脱硝技术的主反应为:
4NH3(g)+4NO(g)+O2(g) ![]() 4N2(g)+6H2O(g) △H<0
4N2(g)+6H2O(g) △H<0
副反应:4NH3(g)+4O2 (g) ![]() 2N2O (g)+6H2O (g) △H<0
2N2O (g)+6H2O (g) △H<0
下表在密闭体系中进行实验,起始投入一定量NH3、NO、O2,测定不同温度下,在相同时间内各组分的浓度。
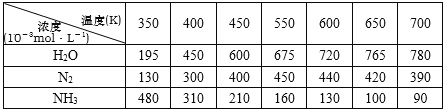
N2浓度变化趋势___________________,试解释原因______________________,
根据表中数据推测,副反应开始发生的温度区间是_____________________。
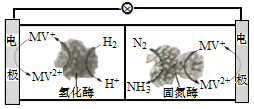
(3)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。请写出氮气在固氮酶作用下发生的化学反应_________。
【答案】② K=![]() 先上升后下降 先上升:反应还未到达平衡状态,温度越高,化学反应速率越快,单位时间内N2浓度越大;后下降:达到平衡状态后,随着温度升高,因反应正向放热,平衡逆向移动, N2浓度降低 550K—600K之间 N2+6H++6MV+=2NH3+6MV2+
先上升后下降 先上升:反应还未到达平衡状态,温度越高,化学反应速率越快,单位时间内N2浓度越大;后下降:达到平衡状态后,随着温度升高,因反应正向放热,平衡逆向移动, N2浓度降低 550K—600K之间 N2+6H++6MV+=2NH3+6MV2+
【解析】
(1)决定2NO(g)+O2(g) ![]() 2NO2(g)反应速率快慢决定于进行慢的反应,即反应②;一定条件下,反应2NO(g)+O2(g)
2NO2(g)反应速率快慢决定于进行慢的反应,即反应②;一定条件下,反应2NO(g)+O2(g) ![]() 2NO2(g)达到平衡状态,即υ正=υ逆,两个基元反应也要遵循平衡时正逆反应速率相等,则υ1正=υ1逆,即k1正c2(NO) =k1逆c(N2O2),则
2NO2(g)达到平衡状态,即υ正=υ逆,两个基元反应也要遵循平衡时正逆反应速率相等,则υ1正=υ1逆,即k1正c2(NO) =k1逆c(N2O2),则![]() ,υ2正=υ2逆,即k2正c(N2O2)c(O2)=k2逆c2(NO2),则
,υ2正=υ2逆,即k2正c(N2O2)c(O2)=k2逆c2(NO2),则 ,因此该反应平衡常数K=
,因此该反应平衡常数K= =
= =
=![]() 。
。
(2)根据表格数据可知,反应还未到达平衡状态,温度越高,化学反应速率越快,单位时间内N2浓度越大;达到平衡状态后,随着温度升高,因反应正向放热,平衡逆向移动, N2浓度降低,N2浓度变化趋势为先上升,后下降;根据数据,550K时N2浓度达到最大,且550K之前转化的NH3与生成的N2物质的量相等,之后继续升温,N2浓度开始减小,温度过高导致氨气与氧气发生副反应,产生一氧化二氮,副反应开始发生的温度区间是550K—600K之间;
(3)根据示意图所示,氢气在氢化酶的作用下与MV2+反应生成H+和MV+,氮气在固氮酶的作用下与MV+、氢离子反应生成氨气和MV2+,可得到反应方程式。
(1)决定2NO(g)+O2(g) ![]() 2NO2(g)反应速率快慢决定于进行慢的反应,即反应②;一定条件下,反应2NO(g)+O2(g)
2NO2(g)反应速率快慢决定于进行慢的反应,即反应②;一定条件下,反应2NO(g)+O2(g) ![]() 2NO2(g)达到平衡状态,即υ正=υ逆,则υ1正=υ1逆,即k1正c2(NO) =k1逆c(N2O2),则
2NO2(g)达到平衡状态,即υ正=υ逆,则υ1正=υ1逆,即k1正c2(NO) =k1逆c(N2O2),则![]() ,υ2正=υ2逆,即k2正c(N2O2)c(O2)=k2逆c2(NO2),则
,υ2正=υ2逆,即k2正c(N2O2)c(O2)=k2逆c2(NO2),则 ,因此该反应平衡常数K=
,因此该反应平衡常数K= =
= =
=![]() ,
,
答案为:②;![]() ;
;
(2)根据表格数据可知,反应还未到达平衡状态,温度越高,化学反应速率越快,单位时间内N2浓度越大;达到平衡状态后,随着温度升高,因反应正向放热,平衡逆向移动, N2浓度降低,N2浓度变化趋势为先上升,后下降;根据数据,550K时N2浓度达到最大,且550K之前转化的NH3与生成的N2物质的量相等,之后继续升温,N2浓度开始减小,温度过高导致氨气与氧气发生副反应,产生一氧化二氮,副反应开始发生的温度区间是550K—600K之间;
答案为:先上升:反应还未到达平衡状态,温度越高,化学反应速率越快,单位时间内N2浓度越大;后下降:达到平衡状态后,随着温度升高,因反应正向放热,平衡逆向移动, N2浓度降低;550K—600K之间;
(3) 根据示意图所示,氢气在氢化酶的作用下与MV2+反应生成H+和MV+,氮气在固氮酶的作用下与MV+、氢离子反应生成氨气和MV2+,则氮气在固氮酶作用下发生的化学反应为N2+6H++6MV+=2NH3+6MV2+,
答案为:N2+6H++6MV+=2NH3+6MV2+。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】某学生用0.1000mol·L-1标准NaOH溶液滴定未知浓度的盐酸,其操作为以下几步:
A.用标准NaOH溶液润洗碱式滴定管2~3次
B.取标准NaOH溶液注入碱式滴定管到“0”刻度以上2~3cm
C.把盛有标准NaOH溶液的碱式滴定管固定好,挤压玻璃珠,使滴定管尖嘴充满溶液
D.调节液面至“0”或“0”刻度以下,记下读数
E.移取25.00mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞溶液
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定到终点,并记下滴定管液面的读数
(1)下图中属于碱式滴定管的_____(选填:“甲”、“乙”)。

(2)判断到达滴定终点的实验现象是_____。
(3)上述E步操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响是_____(填“偏大”或“偏小”或“无影响”)。
(4)若平行实验三次,记录的数据如下表
滴定次数 | 待测溶液的体积(/mL) | 标准NaOH溶液的体积 | |
滴定前读数(/mL) | 滴定后读数(/mL) | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
试计算待测盐酸的物质的量浓度(写出计算过程)________。