题目内容
【题目】某研究小组为了探究SO2的实验室制法和有关化学性质,设计了如下的实验。
实验I:
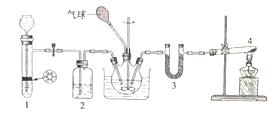
(1)实验基本操作
①多孔隔板与活塞相配合,能起到的作用是_____________________________________.
②该实验制H2时需用浓硫酸配制480mL 3 mol/L的稀硫酸,配制中所需的玻璃仪器有250 mL烧杯、l 00mL量筒、玻璃棒、胶头滴管等,还需_______________________.
③该实验过程中H2所起的作用是_____________________________.
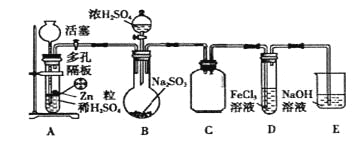
(2)实验时先打开活塞,让装置A内试剂反应一段时间后,关闭活塞,再往装置B中滴入适量浓硫酸反应片刻后,甲、乙两学生分别取装置D中少量溶液,甲学生往其中加入酸性KMnO4溶液,观察到酸性KMnO4溶液紫红色褪去;乙学生往其中加入盐酸酸化的BaCl2溶液,观察到有白色沉淀生成。根据各自实验现象甲、乙学生得出SO2被Fe3+氧化。
①试判断甲、乙学生的结论是否严谨________________(填写选项)。
A.甲学生严谨 B.乙学生严谨 C.甲、乙学生都不严谨
②写出SO2被Fe3+氧化的离子反应方程式_____________________________________.
实验II:
(3)该研究小组为测定SO2催化氧化为SO3的转化率,又设计了如下实验:已知SO3熔点为16.8℃,且忽略空气中CO2的影响).
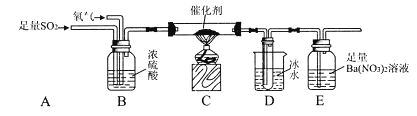
①当停止通入SO2,熄灭酒精灯后,需要继续通入氧气,其目的是:____________________.
②实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是_______________(用含字母的代数式表示,不用化简)。
【答案】可控制反应随时进行也可随时停止(或能起启普发生器的功能等,但答控制反应速率不得分) 500mL容量瓶 排尽装置中的空气 B SO2+2Fe3++2H2O=2Fe2++SO42-+4H+ 使残留在装置中的二氧化硫和三氧化硫被充分吸收 ![]()
【解析】
根据实验目的和装置中的信息可知,A装置用于制备氢气以排出系统中的空气,以防氧气干扰二氧化硫的性质检验;B装置用于制备二氧化硫;C装置是安全瓶;D装置用于探究二氧化硫的还原性;E装置是尾气处理装置。测定SO2催化氧化为SO3的转化率的装置中,B装置用于干燥混合气并控制两种组分的比例和流速;C装置是催化氧化装置:D装置用于收集三氧化硫:E装置用于吸收二氧化硫。根据D和E中的固体的质量可以求出SO3的转化率。
(1)①固体放在隔板上,与液体接触即可反应,若关闭活塞,气体将液体压回长颈漏斗中,与固体分离,反应即可停止,所以此装置可控制反应随时进行也可随时停止。
②因为需要配制480mL的溶液,需要选择稍大的500mL容量瓶。
③该实验过程中H2所起的作用是:用氢气排尽装置中的空气。这样做的目的是为了防止氧气影响后面的反应。
(2)①甲同学加入酸性高锰酸钾溶液,亚铁离子能被高锰酸钾氧化,二氧化硫和亚硫酸也能被氧化,所以不能说明二氧化硫被铁离子氧化;而乙同学是检验反应后生成的硫酸根离子,有硫酸钡沉淀生成,就说明二氧化硫被铁离子氧化成了硫酸根离子,所以选B。
②二氧化硫被铁离子氧化成硫酸根,同时生成亚铁离子,离子方程式为:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+
(3)①当停止通入SO2,熄灭酒精灯后,继续通入氧气是为了使残留在装置中的二氧化硫和三氧化硫被赶到后面容器中被充分吸收。
②装置D中为冷却得到的三氧化硫,装置E中 二氧化硫被硝酸氧化后与氯化钡反应产生的白色沉淀为硫酸钡沉淀,根据S元素守恒,可以计算出二氧化硫的转化率为![]() 。
。

【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。
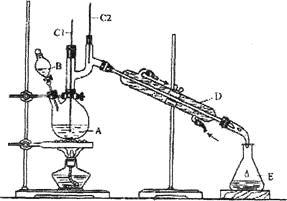
发生的反应如下:
CH3CH2CH2CH2OH![]() CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm﹣3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g。回答下列问题:
(1)上述装置图中,B仪器的名称是__________,D仪器的名称是__________;
(2)加入沸石的作用是__________;
(3)分液漏斗使用前必须进行的操作是__________ (填正确答案标号);
a.润湿 b.干燥 c.检漏 d.标定
(4)将正丁醛粗产品置于分液漏斗中分水时,水在__________层(填“上”或“下”);
(5)反应温度应保持在90~95℃。其原因是______________________________;
(6)本实验中,正丁醛的产率为__________%。
【题目】某学生用0.1000mol·L-1标准NaOH溶液滴定未知浓度的盐酸,其操作为以下几步:
A.用标准NaOH溶液润洗碱式滴定管2~3次
B.取标准NaOH溶液注入碱式滴定管到“0”刻度以上2~3cm
C.把盛有标准NaOH溶液的碱式滴定管固定好,挤压玻璃珠,使滴定管尖嘴充满溶液
D.调节液面至“0”或“0”刻度以下,记下读数
E.移取25.00mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞溶液
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定到终点,并记下滴定管液面的读数
(1)下图中属于碱式滴定管的_____(选填:“甲”、“乙”)。

(2)判断到达滴定终点的实验现象是_____。
(3)上述E步操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响是_____(填“偏大”或“偏小”或“无影响”)。
(4)若平行实验三次,记录的数据如下表
滴定次数 | 待测溶液的体积(/mL) | 标准NaOH溶液的体积 | |
滴定前读数(/mL) | 滴定后读数(/mL) | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
试计算待测盐酸的物质的量浓度(写出计算过程)________。