题目内容
7.下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).则下列有关Y的意义的叙述正确的是 ( )| A. | 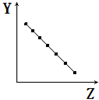 表示第三周期元素的原子半径(稀有气体除外) | |
| B. | 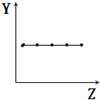 表示ⅡA族元素的最外层电子数 | |
| C. | 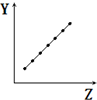 表示第二周期元素的电负性(稀有气体除外) | |
| D. | 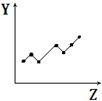 表示第三周期元素的第一电离能(稀有气体除外) | |
| E. | 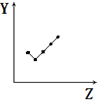 表示第ⅦA族元素氢化物的沸点. |
分析 A.同周期随原子序数增大,原子半径减小;
B.同主族元素原子最外层电子数相等;
C.同周期随原子序数增大,电负性增大;
D.同周期随原子序数增大,元素第一电离能呈增大趋势,但ⅡA族、ⅤA族元素第一电离能高于同周期相邻元素;
E.HF分子之间存在氢键,沸点最高.
解答 解:A.同周期随原子序数增大,原子半径减小,图象符合变化关系,故A正确;
B.ⅡA族元素的最外层电子数均为2,图象符合题意,故B正确;
C.同周期随原子序数增大,电负性增大,图象符合题意,故C正确;
D.第三周期随原子序数增大,元素第一电离能呈增大趋势,但Mg、P元素第一电离能高于同周期相邻元素,而图中Si元素第一电离能高于同周期相邻元素,图象不符合题意,故D错误;
E.HF分子之间存在氢键,沸点最高,故E错误,
故选ABC.
点评 本题考查元素周期律、氢键对物质性质的影响,难度不大,注意同周期中第一电离能异常情况,D选项为易错点,学生容易考虑变化趋势,忽略具体元素.

练习册系列答案
相关题目
15.丙烷是一种重要的烷烃,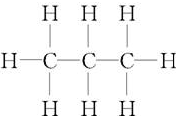 表示其( )
表示其( )
 表示其( )
表示其( )| A. | 结构简式 | B. | 结构式 | C. | 电子式 | D. | 分子式 |
2. 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断正确的是( )
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断正确的是( )
 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断正确的是( )
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断正确的是( )| A. | Ksp[Fe(OH)3]<Ksp[Cu(OH)2] | |
| B. | 加适量NH4Cl固体可使溶液由a点变到b点 | |
| C. | 对a、b两点的Ksp前者大于后者 | |
| D. | Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和 |
17.请以FeSO4溶液、KI溶液、氯水为试剂探究Fe2+和I-的还原性强弱.
①提出假设:假设1:Fe2+还原性强于I-;假设2:I-还原性强于Fe2+
②设计实验方案,写出实验步骤、预期现象和结论.其他限选试剂:3mol•L-1 H2SO4、0.01mol•L-1KMnO4、20% KSCN、3%H2O2、淀粉溶液、紫色石蕊溶液.
①提出假设:假设1:Fe2+还原性强于I-;假设2:I-还原性强于Fe2+
②设计实验方案,写出实验步骤、预期现象和结论.其他限选试剂:3mol•L-1 H2SO4、0.01mol•L-1KMnO4、20% KSCN、3%H2O2、淀粉溶液、紫色石蕊溶液.
| 实 实验步骤 | 预期现象与结论 |
| 步步骤1:取2mLFeSO4溶液和2mLKI溶液混合于试管中,再滴加再滴加几滴氯水. | 溶 溶液变成黄色,推测有Fe3+或I2生成. |
| 步骤2:向试管中继续滴加几滴20%KSCN溶液或向试管中继续滴加几滴淀粉溶液 | 溶液不变红,说明I-的还原性强于Fe2+或溶液变蓝,说明I-的还原性强于Fe2+ |
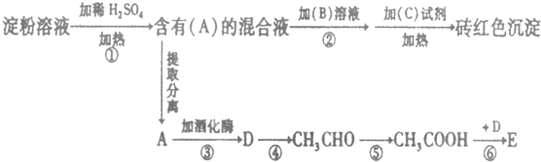
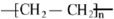 .
.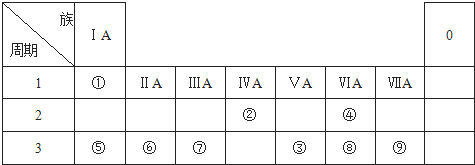
 ;元素⑦的原子结构示意图
;元素⑦的原子结构示意图 .
.
 .
.
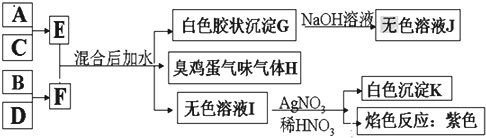
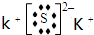
 X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核.通常状况下,W为无色液体.已知:X+Y$\stackrel{△}{→}$Z+W
X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核.通常状况下,W为无色液体.已知:X+Y$\stackrel{△}{→}$Z+W .
.