题目内容
19.如图各物质是中学化学中常见的物质,甲、乙均是离子化合物,且阴、阳离子个数比为1:1.甲可作发酵粉,乙是一种常用的化肥.B、D常温下是气体.请回答下列问题: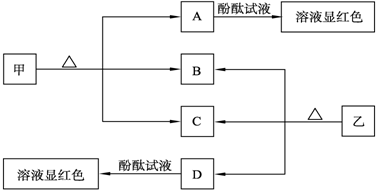
(1)甲的俗名是小苏打.
(2)D的水溶液滴入酚酞试液后,溶液显红色,说明D溶液显碱性性,请用必要的文字加以解释并写出相关的离子方程式:D为NH3,溶于水生成的NH3•H2O为溶解,发生电离NH3•H2O=NH4++OH-.
(3)乙溶液与过量的KOH溶液共热,试写出反应的离子方程式:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+NH3↑+2H2O.
分析 甲、乙均是离子化合物,且阴、阳离子个数比为1:1,甲可作发酵粉,则甲为NaHCO3,A为Na2CO3,乙是一种常用的化肥,由图中转化关系可知,乙为NH4HCO3,则B为CO2,D为NH3,C为H2O,以此解答该题.
解答 解:甲、乙均是离子化合物,且阴、阳离子个数比为1:1,甲可作发酵粉,则甲为NaHCO3,A为Na2CO3,乙是一种常用的化肥,由图中转化关系可知,乙为NH4HCO3,则B为CO2,D为NH3,C为H2O.
(1)由以上分析,可知甲为NaHCO3,俗名小苏打,故答案为:小苏打;
(2)D为NH3,溶于水生成的NH3•H2O为溶解,发生电离NH3•H2O=NH4++OH-,溶液显碱性,加入酚酞后溶液显红色,
故答案为:碱性;D为NH3,溶于水生成的NH3•H2O为溶解,发生电离NH3•H2O=NH4++OH-;
(3)乙为NH4HCO3,与过量的KOH溶液共热,反应的离子方程式:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+NH3↑+2H2O,故答案为:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+NH3↑+2H2O.
点评 本题考查无机物的推断,注意根据物质的用途、组成及分解反应等进行推断,需要学生熟练掌握元素化合物知识,难度中等.

练习册系列答案
相关题目
10.在恒容密闭容器中,一定温度下,可逆反应A(s)+3B(g)?2C(g)+D(g)达到平衡状态的标志是( )
| A. | 混合气体的密度不再改变的状态 | |
| B. | 单位时间生成2n mol C,同时生成n mol D | |
| C. | 混合气体的压强不再改变的状态 | |
| D. | A、B、C、D的分子数之比为1:3:2:1 |
7.下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).则下列有关Y的意义的叙述正确的是 ( )
| A. | 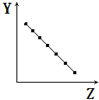 表示第三周期元素的原子半径(稀有气体除外) | |
| B. | 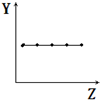 表示ⅡA族元素的最外层电子数 | |
| C. | 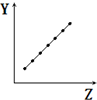 表示第二周期元素的电负性(稀有气体除外) | |
| D. | 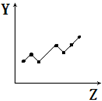 表示第三周期元素的第一电离能(稀有气体除外) | |
| E. | 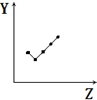 表示第ⅦA族元素氢化物的沸点. |
4.化学与科学、技术、社会、环境密切相关,下列做法中正确的是( )
| A. | 研制乙醇汽油(汽油中添加一定比例乙醇)技术,不能降低机动车尾气中有害气体排放 | |
| B. | 工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏 | |
| C. | 为了有效的发展清洁能源,采用电解水的方法大量制备H2 | |
| D. | 世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体 | |
| E. | 利用化学反应原理,设计和制造新的药物 |
8.在一固定体积的密闭容器中,在850℃时发生如下反应:CO(g)+H2O(g)$\stackrel{催化剂}{?}$CO2(g)+H2(g),容器内各物质的浓度(mol/L)变化如下(在850℃时其化学平衡常数K=1.0).
(1)下列可以作为判断该反应已经达到化学平衡状态依据的是C.
A.容器内压强不变
B.CO的消耗速率等于CO2的生成速率
C.混合气体中CO的体积分数不变
D.c(CO2):c(H2)=1:l
(2)上表中:cl=0.08mol/L.
| 时间/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
A.容器内压强不变
B.CO的消耗速率等于CO2的生成速率
C.混合气体中CO的体积分数不变
D.c(CO2):c(H2)=1:l
(2)上表中:cl=0.08mol/L.
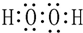
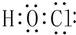
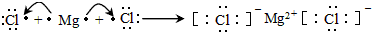
 如图为一些常见物质间的相互转化关系,其中F为金属,高温下能与某些金属氧化物反应,是工业冶炼金属的方法之一. A为无色气体,B为淡黄色固体,C为无色液体,E和J为无色气体单质.
如图为一些常见物质间的相互转化关系,其中F为金属,高温下能与某些金属氧化物反应,是工业冶炼金属的方法之一. A为无色气体,B为淡黄色固体,C为无色液体,E和J为无色气体单质. ;
;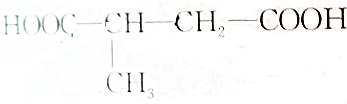 ,该烯烃的结构简式和名称为CH3CH═CHCH(CH3)CH2CH═CHCH2CH3,4-甲基-2,7-壬二烯.
,该烯烃的结构简式和名称为CH3CH═CHCH(CH3)CH2CH═CHCH2CH3,4-甲基-2,7-壬二烯.